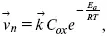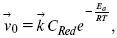α – коэффициент переноса заряда – характеризует степень влияния электрического поля электрода на энергию активации электрохимической стадии и определяет симметрию катодного и анодного процессов, зависит от формы потенциальных кривых.
α ≈ 0,5.
При одном и том же отклонении потенциала электрода от равновесного значения скорости реакции результативная плотность тока будет тем больше, чем выше i 0. Ток обмена i 0зависит от природы электрохимической реакции, материала электрода и состава раствора.
Константа скорости– скорость реакции при единичных концентрациях.
Скорость прямой реакции:
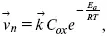
где k – константа, зависящая от свойств системы и способа выражения скорости процесса;
C ox – концентрация реагирующих частиц;
E a – энергия активации разряда в отсутствии скачка потенциала между металлом и раствором.
Скорость обратной реакции
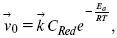
где C Red– концентрация частиц Red (восстановление продуктов);
Е a– энергия активации реакции ионизации при скачке потенциала между металлом и раствором, равным нулю.
Энергия активации электрохимического процесса зависит от величины электродного потенциала, природы ее непосредственных участников и электрода.
Энергия активации при постоянном перенапряжении η – эффективная энергия активации. Если энергия активации не зависит от перенапряжения, то ее появление замедляет диффузию.
Метод расчета величин α и i 0основан на явлении редоксикинетического эффекта заключается в том, что при наложении переменного тока на электрод его потенциал смещается в ту или иную сторону на некоторую величину от первоначального значения. Это смещение – редоксикинетический потенциал ψ. Связь редоксикинетического потенциала ψ с кинетическими параметрами а и i 0такая: если наложить переменный ток на электрод, находящийся в равновесии с соответствующими ионами в растворе, то за время катодного полупериода он окажется заполяризованным катодно, причем зависимость между η и i при условии замедленности стадии разряда будет передаваться уравнением

При достаточном удалении от состояния равновесия

Из последнего выражения следует, если α= 0,5, то ψ = 0, чем сильнее α отклонена от 0,5, тем больше ψ.
Энергия активизации– энергия, представляющая собой минимальную энергию, достаточную для осуществления акта химической реакции.
2. Уравнения электрохимической кинетики, пределы их применимости
1-й закон Фарадеяустанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества.
Δ m = k эJt = k эq , (1)
где Δ m – количество прореагировавшего вещества;
k – коэффициент пропорциональности;
q – количество электричества, равное произведению силы тока I на время t .
Если q = Jt = 1, то Δ m = k э – количество вещества, прореагировавшего в результате протекания единицы количества электричества.
k э – электрохимический эквивалент.
2-й закон Фарадеяустанавливает связь между количеством прореагировавшего вещества при пропускании данного количества электричества и его природой.
По этому закону, при постоянном количестве прошедшего электричества массы прореагировавших веществ относятся между собой, как их химические эквиваленты А :

Если количество электричества равно F , числу Фарадея, то Δ m 1= Fk э 1= A 1, Fk э при q = 1 F , то

Уравнение (3) позволяет объединить оба закона Фарадея в виде одного общего закона, по которому количество электричества (1F = 96500k) всегда изменяет электрохимически массу любого вещества, независимо от его природы.
Читать дальше
Конец ознакомительного отрывка
Купить книгу