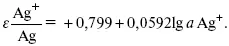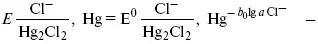Электроды первого рода.В случае металлических электродов первого рода такими ионами будут катионы металла, а в случае металлоидных электродов первого рода – анионы металлоида. Серебряный электрод первого рода Ag +/Ag. Ему отвечает реакция Ag ++ e - = Ag и электродный потенциал
E Ag +/Ag = Ag +/ Ag+ b 0lg a Ag +.
После подстановки численных значений Е 0и b 0при 25 oС:
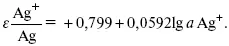
Примером металлоидных электродов первого рода может служить селеновый электрод Se 2–/Se, Se + 2 e - = Se 2; при 25 oС E Se 2–/Se 0= –0,92 – 0,03lg a Se 2–.
Электроды второго рода– полуэлементы, состоящие из металла, покрытого слоем труднорастворимого соединения (соли, оксида или гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить так: А Z– / MA , M , а протекающую в нем реакцию – МА + ze = М + А Z –. Отсюда уравнением для электродного потенциала будет:

Каломельные электроды– это ртуть, покрытая пастой из каломели, и ртуть, находящаяся в контакте с раствором KCl.
Cl –/ Hg 2Cl 2, Hg.
Электродная реакция сводится к восстановлению каломели до металлической ртути и аниона хлора:

Потенциал каломельного электрода обратим по отношению к ионам хлора и определяется их активностью:
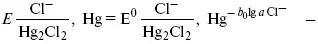
При 25 оС потенциал каломельного электрода находят по уравнению:

Ртутно-сульфатные электродыSO 4 2 –/Hg 2SO 4, Hg аналогичны каломельным с той лишь разницей, что ртуть здесь покрыта слоем пасты из Hg и закисного сульфата ртути, а в качестве раствора используется H 2SO 4. Потенциал ртутно-сульфатного электрода при 25 oС выражается уравнением:

Хлорсеребряный электродпредставляет собой систему Cl –/AgCl, Ag, а его потенциалу отвечает уравнение:
E Cl –/AgCl, Ag = E 0Cl –/AgCl, Ag – b lg a Cl–
или при 25 оС:
E Cl –/AgCl, Ag = 0,2224 – 0,0592 lg a Cl –.
Электроды сравнения– электроды, используемые при измерении электродных потенциалов в паре с используемым электродом. Электродный потенциал– скачок потенциала на границе металл-раствор. Он определяется: природой металла, раствора, концентрацией, температурой. Для сравнения электродных потенциалов нужны стандартные условия: t = 25 °С = 298 К; Р – 1 атм, одномолярный раствор. Абсолютное значение электродного потенциала измерить нельзя. Поэтому измеряют разность потенциалов между данным электродом и электродом сравнения, потенциал которого принимают равным нулю. Часто используют водородный электрод, изготовленный из губчатой платины с сильно развитой поверхностью (платиновая чернь), опускают в раствор H 2SO 4– серной кислоты с активностью ионов водорода, равной единице. При этом через раствор пропускается газообразный водород под давлением, который затем адсорбируется платиной. Относительно потенциала водородного электрода все металлы располагают в ряд напряжений, установленный электрически Н. Н. Бекетовым, взаимному вытеснению металлов в зависимости от величины и знака стандартного электродного потенциала. Существуют и другие электроды сравнения: каломельный, хлорсеребряный и другие, в зависимости от различных методов. Конструктивное оформление электрода сравнения разнообразно. Например, для полярографического метода электроды сравнения должны иметь большую поверхность во избежание поляризации их при работе под током.
ЛЕКЦИЯ № 13. Электрохимическая кинетика
1. Основные кинетические характеристики и методы их расчетов
i 0– ток обмена – кинетическая характеристика равновесия между электродом и раствором при равновесном значении электродного потенциала. Токи обмена относят к 1 см 2поверхности раздела электрод-раствор.
Читать дальше
Конец ознакомительного отрывка
Купить книгу