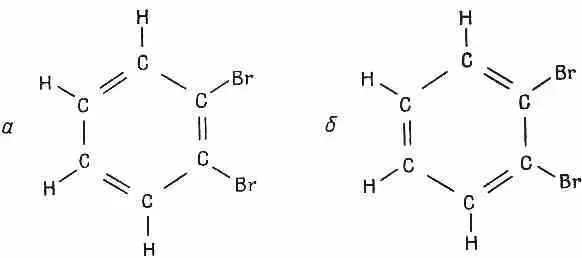
Фиг. 8.7. Две возможности для орто-дибромбензола. Два атома брома могут разделяться либо одиночной связью, либо двойной.
Можно было бы подумать, что должны существовать две разные формы opmo -дибромбензола, но это не так. Есть только одно такое вещество.
Теперь мы собираемся разрешить эти загадки, и вы, может быть, уже догадались как: конечно, дело в том, что «основное состояние» бензольного кольца на самом деле является системой с двумя состояниями. Можно представить себе, что связи в бензоле могут быть расположены двояким образом, как показано на фиг. 8.8.
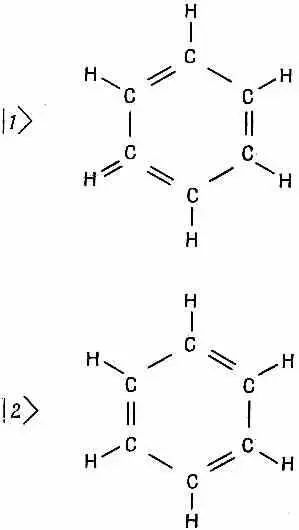
Фиг. 8.8. Совокупность базисных состояний для молекулы бензола.
Вы скажете: «Но ведь это одно и то же; у них должна быть одинаковая энергия». Конечно, должна быть. Именно поэтому их и надо анализировать как систему с двумя состояниями. Каждое состояние представляет другую конфигурацию всей совокупности электронов, и существует некоторая амплитуда А того, что все переплетение переключится с одного расположения на другое, есть какой-то шанс, что электроны смогут сменить фигуру в танце.
Как мы видели, эта вероятность переброса приводит к смешанному состоянию, энергия которого ниже, чем получилось бы, если бы мы рассчитали каждую из схем, представленных на фиг. 8.8, по отдельности. Вместо этого существуют два стационарных состояния: одно с энергией выше, другое — ниже ожидаемого значения. Значит, в действительности истинное нормальное состояние бензола (с наинизшей энергией) не есть какая-либо из возможностей, представленных на фиг. 8.8, а обладает амплитудой 1/Ц2 пребывания в каждом из нарисованных состояний. Это единственное состояние, которое и стоит принимать в расчет в химии бензола при нормальных температурах. Кстати, существует и верхнее состояние; мы вправе так говорить, потому что бензол обладает сильным поглощением света в ультрафиолетовой области с частотой w= (Е I - E II )/ h . Вспомните, что в аммиаке, где прыгающим вверх и вниз объектом являлась тройка протонов, расстояние между энергиями приходилось на микроволновую область. В бензоле таким объектом являются электроны, и, поскольку они намного легче, им и перескакивать туда-сюда тоже намного легче, отчего и коэффициент А становится куда больше. В итоге разница энергий намного больше — около 1,5 эв, а это энергия ультрафиолетового фотона.
Что же происходит, когда мы присоединяем бром? Тогда опять возникают две возможности с двумя разными электронными конфигурациями, показанные на фиг. 8.7. Отличие их в том, что те два базисных состояния, из которых мы исходим, обладают теперь слегка различными энергиями. В стационарное состояние с наинизшей энергией по-прежнему войдет линейная комбинация двух состояний, но с неравными амплитудами. Для состояния | 1 > амплитуда может стать равной, скажем, Ц 2/ 3, для состояния | 2 > она будет Ц 1/ 3чтобы знать коэффициенты точно, нужна добавочная информация, но, во всяком случае, если уж энергии H 11и H 22не равны друг другу, то и амплитуды С 1 и С 2 не могут быть равны между собой. Это, естественно, означает, что одна из двух изображенных на рисунке возможностей более вероятна, чем другая, но все же электроны достаточно подвижны, чтобы и та, и другая обладали какой-то конечной амплитудой. У другого стационарного состояния
амплитуды другие (скажем, Ц 1/ 3и — Ц 2/ 3), но оно лежит при более высокой энергии. Есть только одно наинизшее состояние, а не два, как можно было бы подумать, пользуясь наивной теорией закрепленных химических связей.
§ 5. Красители
Приведем еще один химический пример явления, связанного с двумя состояниями, но на этот раз на уровне крупных молекул. Касается это теории красителей. У многих красителей, а именно у большинства искусственных красителей, есть одна общая характеристика — они обладают своего рода симметрией. На фиг. 8.9 изображен ион одного из красителей — фуксина (он дает пурпурный цвет).
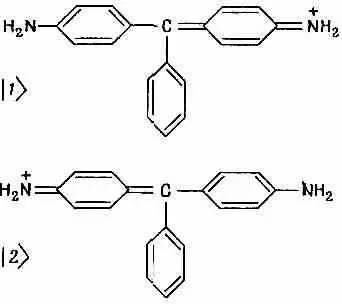
Фиг. 8.9. Пара базисных состояний для молекулы красителя фуксин.
Читать дальше















