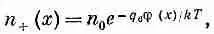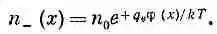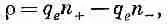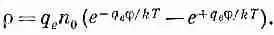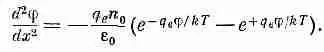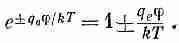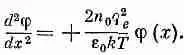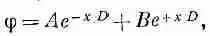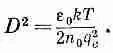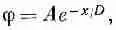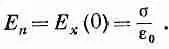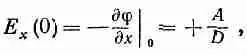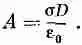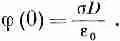Плотность положительных ионов тогда равна
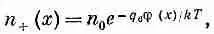
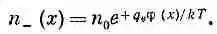
а плотность отрицательных
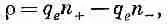
Суммарная плотность заряда
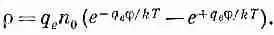
или
(7.30)
Подставляя в (7.28), увидим, что потенциал j должен удовлетворять уравнению
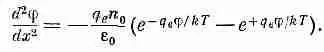
(7.31)
Это уравнение решается в общем виде [помножьте обе его части на 2(dj/dx) и проинтегрируйте по х], но, продолжая упрощать задачу, мы ограничимся здесь только предельным случаем малых потенциалов или высоких температур Т. Малость j отвечает разбавленному раствору. Показатель экспоненты тогда мал, и можно взять
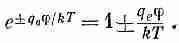
(7.32)
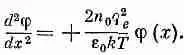
Уравнение (7.31) дает
(7.33)
Заметьте, что теперь в правой части стоит знак плюс (решение не колебательное, а экспоненциальное).
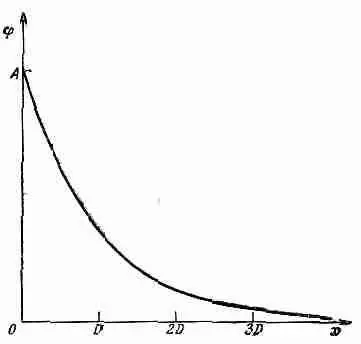
Фиг. 7.7. Изменение потенциала у поверхности коллоидной частицы. D — дебаевская длина.
Общее решение (7.33) имеет вид
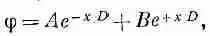
(7.34)
где
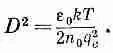
(7.35)
Постоянные А и В определяются из добавочных условий. В нашем случае В должно быть нулем, иначе потенциал для больших х обратится в бесконечность. Итак,
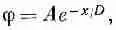
(7.36)
где А — потенциал при x=0 на поверхности коллоидной частицы.
Потенциал убывает в e раз при удалении на D (фиг. 7.7). Число D называется дебаевской длиной; это мера толщины ионной оболочки, окружающей в электролите каждую большую заряженную частицу. Уравнение (7.36) утверждает, что оболочка становится тоньше по мере увеличения концентрации ионов (n 0) или уменьшения температуры.
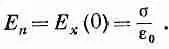
Постоянную А в (7.36) легко получить, если известен поверхностный заряд а на поверхности заряженной частицы. Мы знаем, что
(7.37)
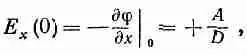
Но Е это также градиент j
(7.38)
откуда получается
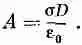
(7.39)
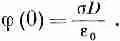
Подставив этот результат в (7.36), мы получим (положив х=0), что потенциал коллоидной частицы равен
(7.40)
Заметьте, что этот потенциал совпадает с разностью потенциалов в конденсаторе с промежутком D и поверхностной плотностью заряда s .
Мы сказали, что коллоидные частицы не слипаются вследствие электрического отталкивания. Но теперь мы видим, что невдалеке от поверхности частицы из-за возникающей вокруг нее ионной оболочки поле спадает. Если бы оболочка стала достаточно тонкой, у частиц появился бы шанс столкнуться друг с другом. Тогда они бы слиплись, коллоид бы осадился и выпал из жидкости. Из нашего анализа ясно, что после добавления в коллоид подходящего количества соли начнется выпадение осадка. Этот процесс называется «высаливанием коллоида».
Другой интересный пример — это влияние растворения соли На осаждение белка. Молекула белка — это длинная, сложная и гибкая цепь аминокислот. На ней там и сям имеются заряды, и временами заряд какого-то одного знака, скажем отрицательного, распределяется вдоль всей цепи. В результате взаимного отталкивания отрицательных зарядов белковая цепь распрямляется. Если в растворе имеются еще другие такие же молекулы-цепочки, то они не слипаются между собой вследствие того же отталкивания. Так возникает в жидкости взвесь молекул-цепочек. Но стоит добавить туда соли, как свойства взвеси изменятся. Уменьшится дебаевская длина, молекулы начнут сближаться и свертываться в спирали. А если соли много, то молекулы белка начнут выпадать в осадок. Существует множество других химических явлений, которые можно понять на основе анализа электрических сил.
Читать дальше