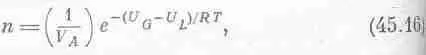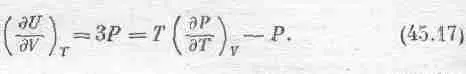Сравнивая два выражения для работы, мы получаем L(DT/T)= DP(V G-V L), или
Уравнение (45.14) связывает скорость изменения давления пара с температурой и количеством тепла, необходимым для испарения жидкости. Хотя вывел его Карно, называется оно уравнением Клаузиуса — Клайперона.
Сравним уравнение (45.14) с результатом, следующим из кинетической теории. Обычно V Gгораздо больше V L . Поэтому V G - V L » V G = RT / P на моль. Если еще предположить, что L — не зависящая от температуры постоянная (хотя это не очень хорошее приближение), то мы получим dP /8 T = L /( RT 2 P ). Вот решение этого дифференциального уравнения:
P=const· e - L / RT . (45.15)
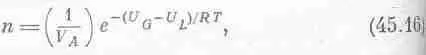
Надо выяснить, в каких отношениях находится это выражение с полученной ранее с помощью кинетической теории зависимостью давления от температуры. Кинетическая теория говорит, хотя и очень неопределенно, что число молекул пара над жидкостью примерно равно
где U G — U L — разность отнесенных к молю внутренних энергий газа и жидкости. Термодинамическое уравнение (45.15) и кинетическое уравнение (45.16) очень похожи, потому что давление равно nkT , но все-таки это разные уравнения. Однако их можно сделать одинаковыми, если заменить старое предположение L=const предположением о том, что L—U G=const. Если предположить, что L— U G — не зависящая от температуры постоянная, то соображения, из которых ранее следовало (45.15), приведут теперь к уравнению (45.16).
Это сравнение показывает преимущества и недостатки термодинамики по сравнению с кинетической теорией. Прежде всего полученное термодинамически уравнение (45.14) — это точное соотношение, а (45.16) — всего-навсего приближение. Ведь нам пришлось предположить, что U приблизительно постоянна и что наша модель верна. Во-вторых, нам, быть может, никогда не удастся понять до конца, как газ переходит в жидкость, и все-таки уравнение (45.14) правильно, а (45.16)— это только приближение. В-третьих, хотя мы говорили о превращении газа в жидкость, наши аргументы верны для любого перехода из одного состояния в другое. Например, переход твердое тело — жидкость описывается кривыми, очень похожими на кривые фиг. 45.3 и 45.4.
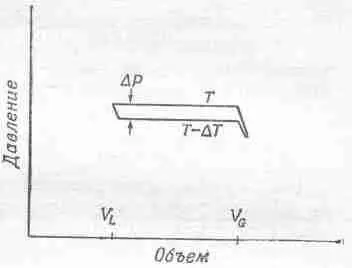
Фиг. 45.4. Диаграмма Р — V для цикла Карно с конденсирующимся в цилиндре паром.
Слева — все вещество переходит в жидкость. Чтобы полностью испарить ее при температуре Т, нужно добавить тепла L . При падении температуры от Т до Т— D T пар расширяется адиабатически.
Вводя скрытую теплоту плавления М/моль, мы получим формулу, аналогичную уравнению (45.14): ( д P пл / д T ) V = M /[ T ( V L - V S )]. Мы можем не знать ничего о кинетической теории процесса плавления, а все же получить правильное уравнение. Однако если мы узнаем кинетическую теорию, то сразу же получим большое преимущество. Уравнение (45.14) — это всего лишь дифференциальное уравнение, и мы еще совершенно не умеем находить постоянные интегрирования. В кинетической теории можно вычислить и эти постоянные, надо только придумать хорошую модель, описывающую все явление полностью. Итак, в каждой теории есть и хорошее, и плохое. Если познания наши слабы, а картина сложна, то термодинамические соотношения оказываются самым мощным средством. Когда же картина упрощается настолько, что можно ее проанализировать теоретически, то лучше сначала попробовать выжать из этого анализа как можно больше.
Еще один пример: излучение черного тела. Мы уже говорили об ящике, содержащем излучение и ничего больше, и уже толковали о равновесии между излучением и осциллятором.
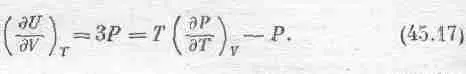
Мы выяснили также, что когда фотоны ударяются о стенки ящика, они создают давление Р. Мы вывели формулу PV=U/3, где U — полная энергия фотонов, а V — объем ящика. Если подставить U=3РV в основное уравнение (45.7),то обнаружится, что
Читать дальше