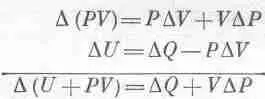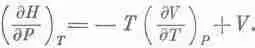Для примера рассмотрим разность электрических потенциалов, или электродвижущую силу (э. д. с.) батареи Е, и заряд DZ, прошедший через батарею. Мы знаем, что работа, производимая обратимой электрической батареей, например аккумулятором, равна EDZ. (Поскольку мы не включили в рассмотрение член PDV, то придется потребовать, чтобы объем оставался постоянным.) Посмотрим, что скажет о работе батареи термодинамика. Если заменить Р на Е, а V на Z, то вместо уравнения (45.6) получится

Это уравнение говорит нам, что при путешествии заряда DZ по батарее меняется внутренняя энергия U . Но почему DU/DZ — это не просто э. д. с. батареи E? Дело в том, что в реальных обстоятельствах движение зарядов внутри батареи вызывает выделение тепла. Внутренняя анергия батареи изменяется, во-первых, за счет работы, производимой батареей во внешней цепи, и, во-вторых, за счет нагревания батареи. Интересно, что вторую часть изменения внутренней энергии опять-таки можно подсчитать, следя, как меняется э. д. с. батареи при изменении температуры. Между прочим, когда заряды текут по батарее, там происходят химические реакции, и уравнение (45.9) указывает на отличный способ измерения необходимой для реакции энергии. Для этого нам нужно лишь сделать батарею, работающую на этой реакции, и сначала просто измерить э. д. с., а потом проследить, как меняется э. д. с. с температурой, если ни один заряд не выпускается из батареи!
Мы предположили, что объем батареи можно поддерживать постоянным, только поэтому мы позволили себе пренебречь членом PDV и считать, что работа батареи равна EDZ. Но оказывается, что поддерживать объем постоянным технически очень трудно. Гораздо легче держать батарею под постоянным атмосферным давлением. Вот почему химики не любят только что написанных нами уравнений: они предпочитают уравнения, которые были бы связаны с постоянным давлением. Мы с самого начала этой главы за независимые переменные приняли V и Т. Химикам больше нравятся Р и Т, поэтому посмотрим теперь, как преобразуются наши выводы при переходе к химической системе переменных. Постарайтесь при этом не ошибиться, потому что мы как-никак сменили детали и перешли от Т и V к Т и Р.
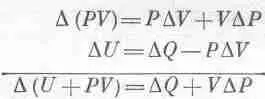
Начнем с (45.3), где DU=DQ-PDV; член PDV можно заменить на E D Z или даже на А D В. Если бы нам удалось как-нибудь заменить PDV на VDP, тогда V и Р поменялись бы ролями и химики остались бы довольны. Тот, кто сообразителен, заметит, что дифференциал произведения PV равен d ( PV )= PdV + VdP . Добавив это равенство к (45.3), он получит
Чтобы все наши последующие выводы походили на выводы из уравнения (45.3), давайте будем считать U+PV какой-то новой функцией, назовем ее энтальпией Н, и напишем в таком виде: DH=DQ+VDP.
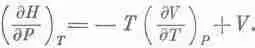
Вот теперь мы готовы перевести все наши рассуждения на химический язык, надо только помнить, что U ® H , Р ® V, V ® P . Химики считают, что вся термодинамика содержится не в уравнении (45.7), а в уравнении
Выяснив, как происходит переход к химическим переменным Т и Р, вернемся к нашим старым переменным. Теперь и уже до конца главы нашими независимыми переменными будут Т и V. Сейчас давайте применим полученные результаты к некоторым физическим процессам. Сначала рассмотрим идеальный газ. Из кинетической теории известно, что внутренняя энергия газа зависит только от характера движения молекул и от их числа. Внутренняя энергия зависит только от Т, а к V она безразлична. Если изменять V при постоянной Т, то U не изменится. Значит, ( dU / dV ) T =0, и уравнение (45.7) говорит нам, что для идеального газа
Т(д P / д T ) V -Р = 0 . (45.10)
Уравнение (45.10) — это дифференциальное уравнение, и оно кое-что расскажет нам о Р. Мы расправимся с частной производной так: поскольку частная производная вычислена при постоянном V , можно заменить частную производную обычной, только надо помнить, что все это делается «при постоянном V ». Уравнение (45.10) тогда принимает вид
Читать дальше