Feynmann - Feynmann 4
Здесь есть возможность читать онлайн «Feynmann - Feynmann 4» весь текст электронной книги совершенно бесплатно (целиком полную версию без сокращений). В некоторых случаях можно слушать аудио, скачать через торрент в формате fb2 и присутствует краткое содержание. Жанр: Старинная литература, на английском языке. Описание произведения, (предисловие) а так же отзывы посетителей доступны на портале библиотеки ЛибКат.
- Название:Feynmann 4
- Автор:
- Жанр:
- Год:неизвестен
- ISBN:нет данных
- Рейтинг книги:4 / 5. Голосов: 1
-
Избранное:Добавить в избранное
- Отзывы:
-
Ваша оценка:
- 80
- 1
- 2
- 3
- 4
- 5
Feynmann 4: краткое содержание, описание и аннотация
Предлагаем к чтению аннотацию, описание, краткое содержание или предисловие (зависит от того, что написал сам автор книги «Feynmann 4»). Если вы не нашли необходимую информацию о книге — напишите в комментариях, мы постараемся отыскать её.
Feynmann 4 — читать онлайн бесплатно полную книгу (весь текст) целиком
Ниже представлен текст книги, разбитый по страницам. Система сохранения места последней прочитанной страницы, позволяет с удобством читать онлайн бесплатно книгу «Feynmann 4», без необходимости каждый раз заново искать на чём Вы остановились. Поставьте закладку, и сможете в любой момент перейти на страницу, на которой закончили чтение.
Интервал:
Закладка:
Т = D P / D T - P =0 (при постоянном V ), (45.11)
интегрирование не составит для нас труда, и мы получим ln P = ln Т +const (при постоянном V ),
P = const X T (при постоянном V ). (45.12)
Мы знаем, что давление идеального газа равно
Р= RT / V . (45.13)
Это соотношение совместимо с (45.12), потому что R и V — постоянные. Но зачем же мы мучились, решая эти уравнения? Ведь результат-то был уже известен. Потому что мы пользовались двумя независимыми определениями температуры! Однажды мы предположили, что кинетическая энергия молекул пропорциональна температуре. Это предположение привело нас к температурной шкале, которую мы назвали шкалой идеального газа. Температура Т в уравнении (45.13) отсчитывается по газовой шкале. Мы называли отсчитанную по газовой шкале температуру кинетической температурой. Потом мы определили температуру иначе, и это определение вообще не нуждалось ни в каком веществе. Исходя из второго закона, мы определили то, что можно назвать «абсолютной термодинамической температурой» Т; она появляется в уравнении (45.12). Здесь мы только доказали, что давление идеального газа (идеальный газ для нас нечто, чья внутренняя энергия не зависит от объема) пропорционально абсолютной термодинамической температуре. Мы, кроме того, знаем, что давление пропорционально температуре, измеренной по газовой шкале. Таким образом, можно заключить, что кинетическая температура пропорциональна «абсолютной термодинамической температуре». Это, конечно, означает, что если бы мы были благоразумны, то показания обеих шкал могли бы всегда жить в согласии. В конце концов эти шкалы можно выбрать так, что они совпадут; постоянную пропорциональности можно положить равной единице. Очень долго люди сами себе создавали трудности, но наконец превратили две шкалы в одну!
§ 3. Уравнение Клаузиуса— Клайперона
Испарение жидкости — это еще одна область, в которой можно применить наши результаты. Предположим, что мы вдвигаем поршень в цилиндр с каким-то веществом.
Естественно задать себе вопрос: как зависит давление от объема, если температура остается постоянной? Иначе говоря, мы хотим начертить изотермические линии на диаграмме Р— V . Вещество в цилиндре — это далеко не идеальный газ, с которым мы имели дело; теперь это жидкость или пар, а может быть, и то и другое вместе. Если сжать вещество достаточно сильно, то оно начнет превращаться в жидкость. Если мы будем увеличивать давление, объем изменится очень мало, а наши изотермы при уменьшении объема пойдут резко вверх, как это показано в левой части фиг. 45.3.
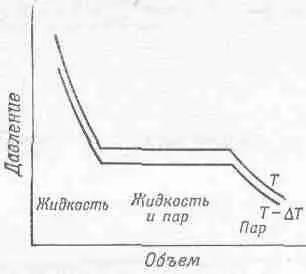
Фиг. 45.3. Изотермы конденсирующегося пара.
Пар сжимается в цилиндре. Слева — все вещество превратилось в жидкость; справа — вся жидкость испарилась; в середине — в цилиндре сосуществуют жидкость и пар.
Если увеличивать объем, выдвигая поршень из цилиндра, давление будет падать, пока мы не достигнем точки кипения жидкости и в цилиндре появится пар. Дальнейшее вытягивание поршня приведет к более сильному испарению. Когда цилиндр заполнен частично паром, а частично жидкостью, то между ними устанавливается равновесие — жидкость испаряется, пар конденсируется, и скорости этих процессов равны. Если предоставить пару больший объем, то, чтобы удержать прежнее давление, понадобится больше пара. Поэтому, хоть жидкость все испаряется, давление остается прежним. Вдоль плоской части кривой на фиг. 45.3 давление не изменяется, это давление называется давлением пара при температуре Т. Если объем все увеличивается, наступит момент, когда запасы жидкости иссякнут. В такой ситуации давление падает при увеличении объема, ведь теперь мы имеем дело с обычным газом; это изображено в правой части диаграммы Р— V . Нижняя кривая на фиг. 45.3— это изотермическая кривая при более низкой температуре Т —D T . Давление жидкости в этом случае немного меньше, потому что с ростом температуры жидкости расширяются (не все жидкости, вода около точки замерзания поступает наоборот), а давление пара при уменьшении температуры, конечно, падает.
Из двух изотерм можно снова построить цикл, соединив концы их плоских участков (скажем, адиабатами), как это показано на фиг. 45.4. Небольшая зазубрина в нижнем правом углу фигуры несущественна, и мы просто забудем о ней. Используем аргументы Карно, которые показывают, как связано тепло, подведенное к жидкости для превращения ее в пар, с работой, совершаемой веществом при обходе цикла. Пусть L—это тепло, необходимое для испарения жидкости в цилиндре. Вспомним, как мы рассуждали при выводе уравнения (45.5), и немедленно скажем, что L ( D T / T ) равно работе, совершенной веществом. Как и раньше, работа вещества равна площади, заключенной внутри цикла. Эта площадь приблизительно равна D P(V G— V L ), где D Р — разность давлений пара при температурах Т и Т— D T, V G — объем газа, a V L — объем жидкости. Оба объема надо измерять при давлении, равном давлению пара.
Читать дальшеИнтервал:
Закладка:
Похожие книги на «Feynmann 4»
Представляем Вашему вниманию похожие книги на «Feynmann 4» списком для выбора. Мы отобрали схожую по названию и смыслу литературу в надежде предоставить читателям больше вариантов отыскать новые, интересные, ещё непрочитанные произведения.
Обсуждение, отзывы о книге «Feynmann 4» и просто собственные мнения читателей. Оставьте ваши комментарии, напишите, что Вы думаете о произведении, его смысле или главных героях. Укажите что конкретно понравилось, а что нет, и почему Вы так считаете.












