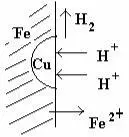
Fе0 – – 2ē = Fе2+
2Н+ + 2ē =H2.
–
Fe + 2H+ = Fе2+ + H2.↑
или
Fe + 2HCl = FeCl2 + H2↓↓
или
На катодах вместо разряда ионов водорода (или молекул воды) может протекать процесс восстановления кислорода, растворенного в электролите:
O2 + 2H2O + 4ē = 4OH-,
т.е. связывание электронов на поверхности катода осуществляется молекулами кислорода. Это так называемая кислородная деполяризация катода. Какой процесс будет протекать, зависит от условий: в кислой среде выделяется водород (происходит водородная деполяризация катода: 2Н + + 2ē =H2.), в нейтральной и щелочной средах (при коррозии стали, железа) происходит кислородная деполяризация катода и водород не выделяется. В этом случае образовавшееся гидроксидионы ОН-
соединяются с перешедшими в раствор ионами Fe2+:
Fe2+ + 2OH– = Fe(OH)2
Гидроксид железа (II) в присутствии воды и кислорода воздуха переходит в гидроксид железа (III):
4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Гидроксид железа (III) можно представить как
2Fe2O3• nH2O
Электрохимическую коррозию вызывают главным образом примеси других металлов и неметаллических веществ или неоднородность поверхности. Согласно теории электрохимической коррозии в этих случаях при соприкосновении металла с электролитом (электролитом может быть влага, адсорбируемая из воздуха) на его поверхности возникают гальванические микроэлементы. При этом металл с более отрицательным потенци-алом разрушается – ионы его переходят в раствор, а электроны переходят к менее активному металлу, на котором происходит восстановление ионов водорода (водородная деполяризация) или восстановление растворенного в воде кислорода (кислородная деполяризация).
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и в случае образования микрогальванических элементов на поверхности одного металла) поток электронов направлен от более активного металла к менее активному (проводнику), и более активный металл корродирует.
Скорость коррозии тем больше, чем дальше расположены друг от друга в ряду стандартных электродных потенциалов те металлы, из которых образовался гальванический элемент (гальваническая пара).
На скорость коррозии влияет и характер раствора электролита. Чем выше его кислотность (т.е. меньше pH), а также чем больше содержание в нем окислителей, тем быстрее протекает коррозия. Значительно возрастает коррозия с ростом температуры.
Некоторые металлы при соприкосновении с кислородом воздуха или в агрессивной среде переходят в пассивное состояние, при котором резко замедляется коррозия. Например, концентрированная азотная кислота легко делает пассивным железо, и оно практически не реагирует с концентрированной азотной кислотой. В таких случаях на поверхности металла образуется плотная защитная оксидная пленка, которая препятствует контакту металла со средой.
Защитная планка всегда имеется на поверхности алюминия. Подобные пленки в сухом воздухе образуются также на Be, Cr, Zn, Ta, Ni, Cu и других металлах. Кислород является наиболее распространенным пассиватором.
Пассивированием объясняется коррозионная стойкость нержавеющих сталей и сплавов.
Защита от коррозии
Коррозия металлов протекает непрерывно и причиняет огромные убытки. Подсчитано, что прямые потери железа от коррозии составляют около 10 % его ежегодной выплавки. В результате коррозии металлические изделия теряют свои ценные технические свойства. Поэтому имеют очень большое значение методы защиты металлов и сплавов от коррозии. Они весьма разнообразны. Назовем некоторые из них.
Защитные поверхностные покрытия металлов
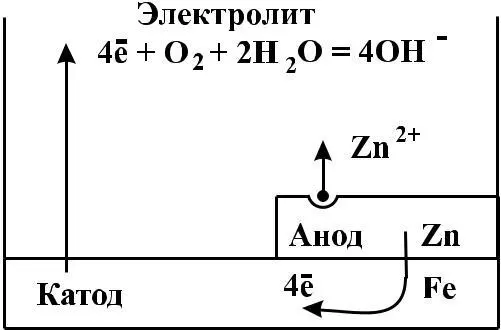
Они бывают металлическими (покрытие цинком, оловом,
свинцом, никелем, хромом,
и другими металлами) и неметаллическими (покрытие лаком, краской, эмалью и
другими веществами). Эти покрытия изолируют металл от внешней среды. Так, кровельное железо покрывают цинком: из оцинкованного железа изготавливают многие изделия бытового и промышленного значения. Слой цинка предохраняет железо от коррозии, так как хотя цинк и является более активным металлом, чем железо (см. ряд стандартных электродных потенциалов металлов), он покрыт оксидной пленкой. При повреждениях защитного слоя (царапины, пробои крыш и т.д.)
Читать дальше
Конец ознакомительного отрывка
Купить книгу














