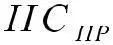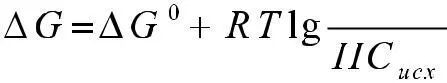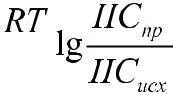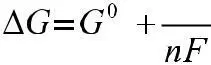ΔG = – A
Работа электрического тока равна произведению числа молей перенесенных электронов n, постоянной Фарадея F = 96484 Кл/ моль и напряжения в электрической цепи. Так как электродный потенциал – это ЭДС гальванической цепи с водородным электродом, то работу электродной реакции можно рассчитать относительно работы реакции стандартного водородного электрода:
A = nE° F
(1)
Поскольку для водородного электрода принято E° = 0, то и работа его реакции также равна нулю, и, следовательно, G°,
H°, S°, для реакции стандартного водородного электрода также равны нулю. Подставляя (1) в равенство G = – А, получаем:
G = – nEF
(2)
G = -nE°F
Изменения изобарного потенциала при нестандартных и стандартных условиях связаны соотношением
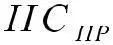
(3)
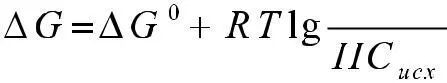
где Писх и ПС ПР – соответственно произведение концентраций (в степени их стехиометрических коэффициентов) продуктов реакции и исходных веществ. Объединяя (2) и (3), получаем:
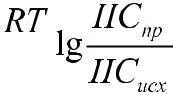
(4)
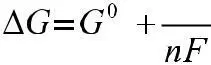
Формула (4) – уравнение Нернста, позволяющее вычислить электродные потенциалы при нестандартных условиях. Для электродного процесса:
Mn+ (p-p) + nē = M(kр)
уравнение ( 4 ) при 298,15 К приобретает вид:
0,059
(5)
Eмn+/м = E°мn+/м – n
lg1/Cмn+
Уравнение Нернста
С помощью уравнения Нернста можно рассчитать электродвижущую силу окислительно-восстановительного процесса при нестандартных концентрациях, если известно стандартное значение Е°. Для окислительно-восстановительной реакции уравнение (5) при 298,15 К записывается так:
0,059
Cм
n+
ox
E = E° – – lg –
n
Cмredn+
где n – число участвующих в реакции электронов; Смn+ – любые нестандартные концентрации ионов в растворе окислителя и восстановителя.
Пользуясь уравнением Нернста, можно рассчитать, например, потенциал цинкового электрода в 0.001 М растворе его соли составит:
Е = -0.76 – 0.0592/2 • lg(1/0.001) = – 0.85 B
Следовательно, при уменьшении концентрации ионов цинка в растворе потенциал металла становится более отрицателен (по отношению к стандартному водородному электроду).
Девиз: “ЭЛЕКТРОЛИЗ
ЛЕКЦИЯ 12.
ЭЛЕКТРОЛИЗ. КОРРОЗИЯ.
План:
Электролиз расплавов и растворов
Электролиз водных растворов электролитов
Применение электролиза
Коррозия металлов Защита от коррозии. Защитные поверхностные покрытия металлов
Электролиз расплавов и растворов.
В растворах и расплавах электролитов имеются разноименные по знаку ионы (катионы и анионы), которые, подобно всем частицам жидкости, находятся в хаотическом движении. Если в такой раствор или расплав электролита, например в расплав хлорида натрия (NаС1 плавится при 80°C), погрузить инертные (угольные) электроды и пропустить постоянный электрический ток, то ионы будут двигаться к электродам: катионы Nа+ – к катоду, анионы Cl – – к аноду . Ионы натрия Nа+, достигнув катода, принимают от него электроны и восстанавливаются: Nа+ + ē = Nа 0, а хлоридионы Cl -, отдав электроны аноду, окисляются: 2Cl– – 2с = Сl2. В итоге на катоде ваделяется металлический натрий, а на аноде хлор.
Если теперь почленно сложить уравнения этих двух электродных реакций (предварительно умножив первое на 2), то получим общее, или суммарное, уравнение электролиза хлорида натрия:
Nа+ + ē = Nа0
2
2Cl– – 2ē = Сl2
1
2Nа+ + 2Cl-
эликтролиз
2Nа + Cl2
эликтролиз
или
2NаCl
2Nа + Cl2


Эта реакция является окислительно-восстановительной: на аноде протекает процесс окисления, на катоде – процесс восстановления.
Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита
Сущность электролиза состоит в осуществлении за счет электрической энергии химических реакций – восстановления на катоде и окисления на аноде. При этом катод отдает электроны катионам, а анод принимает электроны от анионов. Восстановительное и окислительное действие электрического тока во много раз сильнее действия химических восстановителей и окислителей. Так, ни один окислитель не может отнять у фторид-иона F– его электрон. Поэтому долгое время фтор не могли получить в свободном состоянии, хотя его соединения широко распространены в природе. Окисление у фторид-иона удалось лишь при электролизе раствора фторида калия во вто-роводородной кислоте.
Читать дальше
Конец ознакомительного отрывка
Купить книгу