Время рождения координационной химии как науки связы-вают со случайным получением в 1798 году Тассером соединения CoCl3 • 6NH3. Между тем были известны соединения высшего по-рядка и до открытия Тассера. Вероятно, первым подобным соединением, синтезированным в лаборатории, является берлинская лазурь Fe4[Fe(CN)6]3. Она случайно получена художником Дисбахом в 1704г. Ииспользована как красящий пигмент.
На несколько миллиардов лет раньше, природа создала такие соединения высшего порядка как FeSO4 • 7H2O и СuSO4 • 5H2O
(железистый и медный купороc). Первое встречается в виде минерала механтерита, второй в виде халькантита. Человеку они стали известны уже в XIII веке.
Из берлинской лазури и едкого калия Макер в 1749 году впервые получил желтую кровяную соль K4(Fe(CN)6).
Итак, соединения высшего порядка были известны и до Тассера. Однако, только после получения CoCl3 • 6NH3 химики осознали, что имеются соединения, не вписывающиеся ни в какие привычные категории (Петух не делает утра, но он будит).
В становлении и развитии химии К.С. большой вклад был внесен шведскими и датскими химиками Берцелиусом, Бломстрандом, Клеве, Иергенсен. В конце XIX века, центром по изучению химии К.С. стал Цюрих, где работал создатель координационной теории Альфред Вернер. После его кончины важные исследования были выполнены в Германии его учеником Паулем Пфейфером. В начале текущего столетия наибольший прогресс в этой области химии достигнут в нашей стране благодаря Льву Александровичу Чугаеву, который создал уникальную со-ветскую школу химиков-комплексников. Следует отметить, что еще в конце XIX столетия яркий цикл исследований по химии комплексных соединений выполнен в России Николаем Семеновичем Курнаковым. Огромный вклад в химию К.С. внесли Чатт в Великобритании, Дж.Бейлар в США, Л.Силлен в Швеции
многие другие ученые в различных странах.
Теоретические представления о К.С. развивались на основе прочных комплексов довольно узкого круга металлов: КОБАЛЬТА (III), ПЛАТИНЫ (II), ПЛАТИНЫ (IV), ХРОМА (II), МЕДИ(П). Синтез проводился из их солей, а в качестве другой составляющей широко использовался аммиак.
Одной из важнейших вех на пути к координационной теории были аммонийная гипотеза английского ученого Т.Грэма (1840г.). Он усматривал аналогию между взаимодействием ам-
миака с кислотами и с солями металлов.
NH3 + HCl → {H+NH3}Cl
2NH3 + CuCl2 → {Cu2+(NH3)2}Cl2
Эту догадку можно отнести к числу гениальных прозрений. Трудности у Грэма возникали в связи с тем, что число молекул аммиака, присоединившихся к металлу, например в CoCl3 • 6NH3, часто было больше, чем число эквивалентов металла или, говоря современным языком, число присоединившихся молекул аммиака часто превышало степень окисления иона металла (III и 6).
В середине ХIХ века комплексообразование иногда трактовалось как переход III азота в V азот по уравнению:
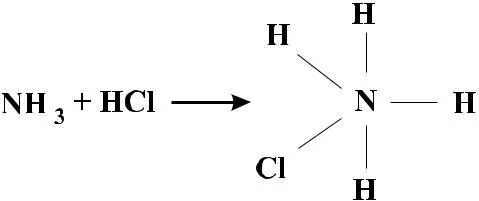
Грем полагал, что вместо одного из атомов водорода в аммо-нийном ионе находится металл:
Известно, что ковалентность азота – З(2р3), и 5-и валентным он быть не может.
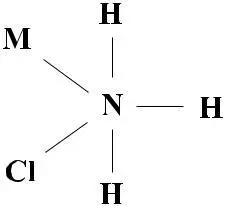
В 1851 году немецкий ученый А.Гофман высказал мысль о том, что атом водорода в аммонийном радикале способен замещаться на другой аммонийный радикал:
Связи N-Cl везде одинаковые, однако, при прибавлении AgNOхлора3. (изб.) в осадок (AgCl) переходили только два атома Следующий шаг сделал швед К.В.Бломстранд (1869г.). Строение хлорида аммония он выразил Н–NH3–Cl. Атом Н способен замещаться металлом, а пятивалентные атомы азота способны соединяться между собой, образуя цепи – NH3—NH3 – (по аналогии с органическими соединениями). По мнению Бломстранда, стабильность цепи атомов зависит от природы атома металла. Платина и медь обеспечивают устойчивость цепи, образованной только двумя атомами азота, а Co, Ni, Ir, Rh способны стабилизировать цепи боль-
шей длины.
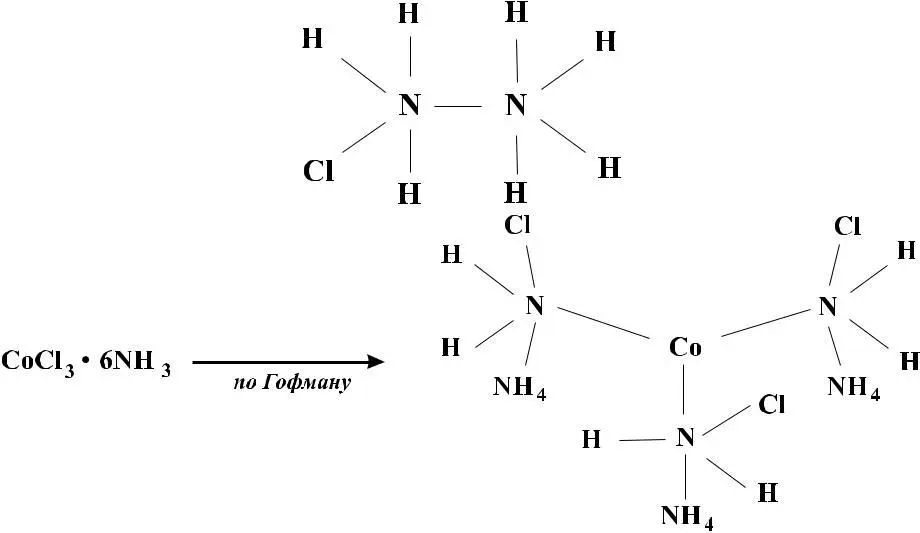
Бломстранд ошибочно считал, что соединение CoCl3 имеет формулу Co2Cl6, поэтому составу CoCl3 • 6NH3 он приписывал структуру:
Если Cl связан с Co, то при добавлении AgNO3 AgCl не вы
падает CoCl3 • 5NH3
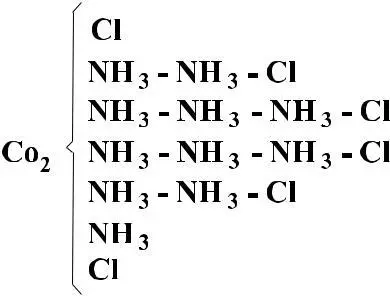
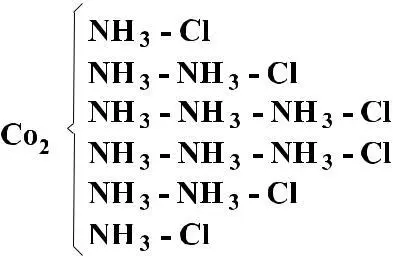
Датский ученый Иергенсен установил, что молекула CoCl3 • 6NH3 соответствует именно этой формуле. Исходя из химических свойств:
Читать дальше
Конец ознакомительного отрывка
Купить книгу

















