Catalytic Asymmetric Synthesis
Здесь есть возможность читать онлайн «Catalytic Asymmetric Synthesis» — ознакомительный отрывок электронной книги совершенно бесплатно, а после прочтения отрывка купить полную версию. В некоторых случаях можно слушать аудио, скачать через торрент в формате fb2 и присутствует краткое содержание. Жанр: unrecognised, на английском языке. Описание произведения, (предисловие) а так же отзывы посетителей доступны на портале библиотеки ЛибКат.
- Название:Catalytic Asymmetric Synthesis
- Автор:
- Жанр:
- Год:неизвестен
- ISBN:нет данных
- Рейтинг книги:5 / 5. Голосов: 1
-
Избранное:Добавить в избранное
- Отзывы:
-
Ваша оценка:
- 100
- 1
- 2
- 3
- 4
- 5
Catalytic Asymmetric Synthesis: краткое содержание, описание и аннотация
Предлагаем к чтению аннотацию, описание, краткое содержание или предисловие (зависит от того, что написал сам автор книги «Catalytic Asymmetric Synthesis»). Если вы не нашли необходимую информацию о книге — напишите в комментариях, мы постараемся отыскать её.
Catalytic Asymmetric Synthesis
Catalytic Asymmetric Synthesis — читать онлайн ознакомительный отрывок
Ниже представлен текст книги, разбитый по страницам. Система сохранения места последней прочитанной страницы, позволяет с удобством читать онлайн бесплатно книгу «Catalytic Asymmetric Synthesis», без необходимости каждый раз заново искать на чём Вы остановились. Поставьте закладку, и сможете в любой момент перейти на страницу, на которой закончили чтение.
Интервал:
Закладка:
86 86. Formica, M.; Rozsar, D.; Su, G.; Farley, A. J. M.; Dixon, D. J. Acc. Chem. Res. 2020, 53, 2235–2247.
87 87. Núñez, M. G.; Farley, A. J. M.; Dixon, D. J. J. Am. Chem. Soc. 2013, 135, 16348–16351.
88 88. (a) Farley, A. J. M.; Sandford, C.; Dixon, D. J. J. Am. Chem. Soc. 2015, 137, 15992–15995. (b) Yang, J.; Farley, A. J. M.; Dixon, D. J. Chem. Sci. 2017, 8, 606–610. (c) Formica, M.; Sorin, G.; Farley A. J. M.; Diaz, J.; Paton, R. S.; Dixon, D. J. Chem. Sci. 2018, 9, 6969–6974.
89 89. Golec, J. C.; Carter, E. M.; Ward, J. W.; Whittingham, W. G.; Simón, L.; Paton, R. S.; Dixon, D. J. Angew. Chem. Int. Ed. 2020, 59, 17417–17422.
90 90. Thomson, C. J.; Barber, D. M.; Dixon, D. J. Angew. Chem. Int. Ed. 2020, 59, 5359–5364.
91 91. Shi, H.; Michaelides, I. N.; Darses, B.; Jakubec, P.; Nguyan, Q. N. N.; Paton, R. S.; Dixon, D. J. J. Am. Chem. Soc. 2017, 139, 17755–17758.
92 92. (a) Horwitz, M. A.; Fulton, J. L.; Johnson, J. S. Org. Lett. 2017, 19, 5783–5785. (b) Fulton, J. L.; Horwitz, M. A.; Bruske, E. L.; Johnson, J. S. J. Org. Chem. 2018, 83, 3385–3391. (c) Horwitz, M. A.; Zavesky, B. P.; Martinez‐Alvarado, J. I.; Johnson, J. S. Org. Lett. 2016, 18, 36–39.
93 93. Schwesinger, R.; Schlemper, H. Angew. Chem. Int. Ed. Engl. 1987, 26, 11617–1169.
94 94. Uraguchi, D.; Ooi, T. J. Synth. Org. Chem. 2010, 68, 1185–1194.
95 95. (a) Uraguchi, D.; Sakaki, S.; Ooi, T. J. Am. Chem. Soc. 2007, 129, 12392–12393. (b) Uraguchi, D.; Ito, T.; Nakamura, S.; Sakaki, S.; Ooi, T. Chem. Lett. 2009, 38, 1052–1053. (c) Uraguchi, D.; Nakamura, S.; Ooi, T. Angew. Chem. Int. Ed. 2010, 49, 7562–7565.
96 96. (a) Uraguchi, D.; Ito, T.; Ooi, T. J. Am. Chem. Soc. 2009, 131, 3836–3837. (b) Uraguchi, D.; Ito, T.; Nakamura, S.; Ooi, T. Chem. Sci. 2010, 1, 488–490. (c) Uraguchi, D.; Ito, T.; Kimura, Y.; Nobori, Y.; Sato, M.; Ooi, T. Bull. Chem. Soc. Jpn. 2017, 90, 546–555.
97 97. Simón, L.; Paton, R. S. J. Org. Chem. 2015, 80, 2756–2766.
98 98. Uraguchi, D.; Yamada, K.; Ooi, T. Angew. Chem. Int. Ed. 2015, 54, 9954–9957.
99 99. (a) Uraguchi, D.; Yoshioka, K.; Ueki, Y.; Ooi, T. J. Am. Chem. Soc. 2012, 134, 19370–19373. (b) Uraguchi, D.; Yoshioka, K.; Ooi, T. Nature Commun. 2017, 8, 14793. (c) Yamanaka, M.; Sakata, K.; Yoshioka, K.; Uraguchi, D.; Ooi, T. J. Org. Chem. 2017, 82, 541–548.
100 100. Uraguchi, D.; Shibazaki, R.; Tanaka, N.; Yamada, K.; Yoshioka, K.; Ooi, T. Angew. Chem. Int. Ed. 2018, 57, 4732–4736.
101 101. Corbett, M. T.; Uraguchi, D.; Ooi, T.; Johnson, J. S. Angew. Chem. Int. Ed. 2012, 51, 4685–4689.
102 102. Horwitz, M. A.; Tanaka, N.; Yokosaka, T.; Uraguchi, D.; Johnson, J. S.; Ooi, T. Chem. Sci. 2015, 6, 6086–6090.
103 103. (a) Uraguchi, D.; Tsutsumi, R.; Ooi, T. J. Am. Chem. Soc. 2013, 135, 8161–8164. (b) Uraguchi, D.; Tsutsumi, R.; Ooi, T. Tetrahedron 2014, 70, 1691–1701. (c) Tanaka, N.; Tsutsumi, R.; Uraguchi, D.; Ooi, T. Chem. Commun. 2017, 53, 6999–7002.
104 104. (a) Takeda, T.; Terada, M. J. Am. Chem. Soc. 2013, 135, 15306–15309. (b) Takeda, T.; Terada, M. Aust. J. Chem. 2014, 67, 1124–1128.
105 105. (a) Kondoh, A.; Oishi, M.; Takeda, T.; Terada, M. Angew. Chem. Int. Ed. 2015, 54, 15836–15839. (b) Takeda, T.; Kondoh, A.; Terada, M. Angew. Chem. Int. Ed. 2016, 55, 4734–4737. (c) Hu, Q.; Kondoh, A.; Terada, M. Chem. Sci. 2018, 9, 4348–4351.
106 106. Das, S.; Hu, Q.; Kondoh, A.; Terada, M. Angew. Chem. Int. Ed. 2021, 60, 1417–1422.
107 107. Kondoh, A.; Akahira, S.; Oishi, M.; Terada, M. Angew. Chem. Int. Ed. 2018, 57, 6299–6303.
108 108. Kondoh, A.; Oishi, M.; Tezuka, H.; Terada, M. Angew. Chem. Int. Ed. 2020, 59, 7472–7477.
4 ASYMMETRIC PHASE‐TRANSFER AND ION‐PAIR ORGANOCATALYSES
Edward Miller, Patrick J. Moon, and F. Dean Toste
University of California, Berkeley, Berkeley, CA, USA
4.1. INTRODUCTION
Asymmetric organocatalysis has become a powerful strategy for the construction of chiral functional molecules and materials, providing unique reactivity manifolds compared to traditional metal‐catalyzed or enzymatic‐based approaches. Within the field, reversible covalent substrate activation or binding with a chiral catalyst (enamine, iminium, or N ‐heterocyclic carbene [NHC] catalysis) has been extensively exploited to achieve highly enantioselective transformations. Conformational analysis of the catalyst‐bound intermediates has permitted the rationalization of the origin of enantioselectivity in a number of reactions, which in turn has helped drive catalyst design with relative ease. Another approach involves the use of noncovalent interactions as the basis for substrate activation and asymmetric induction. Within this category, asymmetric phase‐transfer and ion‐pairing catalyses have proven to be uniquely suited to achieve highly selective reactions involving charged substrates or intermediates ( Scheme 4.1). This chapter will cover key historical and recent developments in the area of chiral cation phase‐transfer and cation‐binding catalyses, in addition to more recent advances in chiral‐anion (phase‐transfer) and anion‐binding catalyses. Additionally, examples featuring transition‐metal and phase‐transfer dual catalysis will also be highlighted.
4.2. CHIRAL CATION
4.2.1. Chiral Cation Phase‐Transfer Catalysis
4.2.1.1. Alkylation
In 1984, Dolling reported the enantioselective methylation of an indanone derivative using a cinchoninium salt phase‐transfer catalyst (PTC, Scheme 4.2) [1]. While phase‐transfer catalysis had already been reported to yield racemic alkylation products, the significance of this landmark study cannot be understated since it demonstrated that chiral information from a catalytically generated ion‐pair could be transferred in an alkylation step to achieve high enantiocontrol. Enantioselectivity is rationalized from a composite of electrostatic, hydrogen bonding, and π–π interactions that selectively block one face of the enolate, allowing for selective alkylation. This ensemble of various noncovalent interactions is a key feature of ion‐pairing catalysis [2].
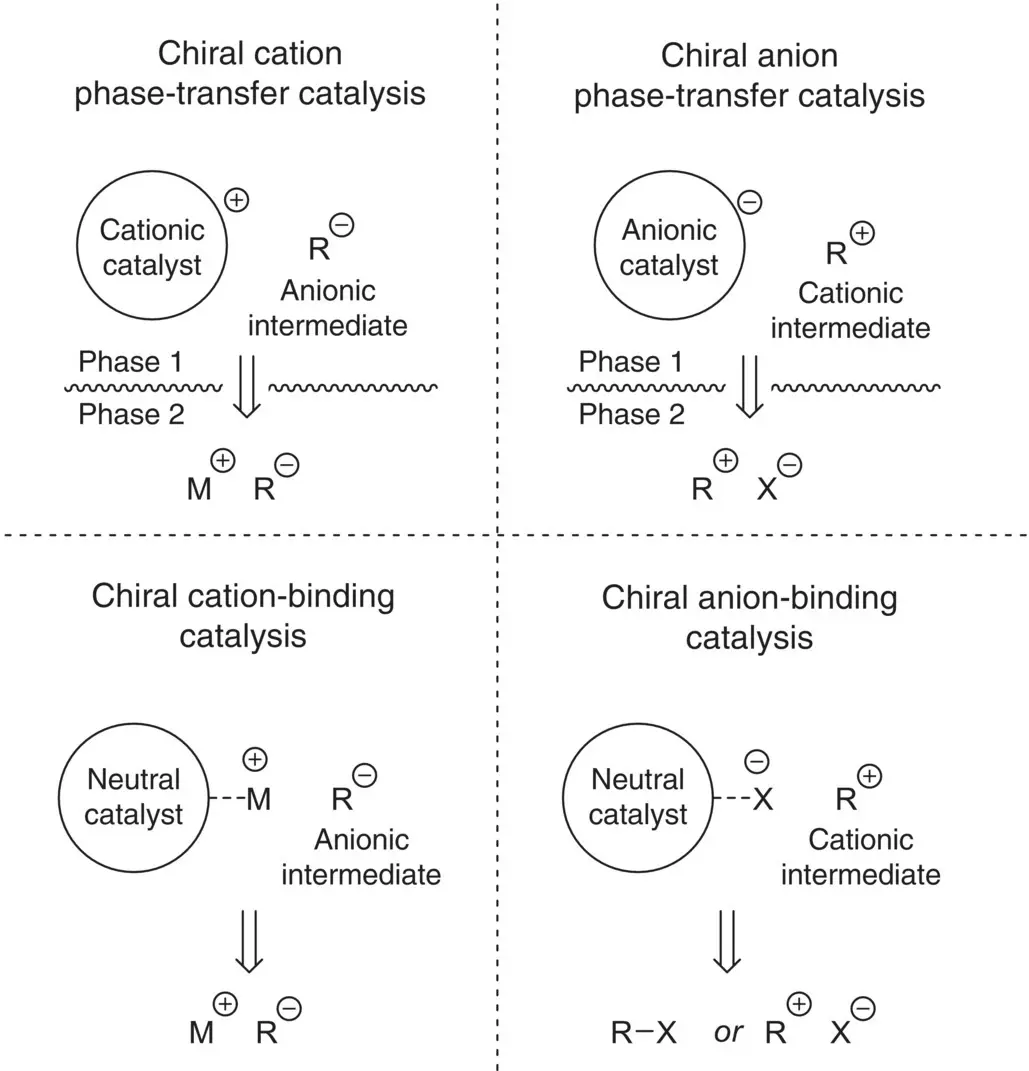
Scheme 4.1. Modes of asymmetric phase‐transfer and ion‐pair organocatalysis.

Scheme 4.2. First enantioselective alkylation using chiral cation phase transfer catalysis.
Source: Based on [2].
In 1989, another key development in the field was reported by O’Donnell: the enantioselective alkylation of benzophenone protected glycine imines using similar cinchoninium PTC ( Scheme 4.3) [3]. This is an operationally simple protocol to access chiral α‐amino acid derivatives upon imine hydrolysis.
In the years following these seminal reports, numbers of other chiral cationic organocatalyst architectures were developed for asymmetric alkylation reactions. The benzylation of tert‐butyl benzophenone glycine imine has since become a classical reaction to benchmark catalysts ( Scheme 4.4). Early efforts focused on modifying the bridgehead nitrogen substituent of the cinchoninium, which proved to have a significant impact on enantioselectivity. In 1997, Lygo [4–6] and Corey [7, 8] independently reported the use of an anthracene‐substituted cinchoninium catalyst for the benzylation of glycine imines to achieve higher enantioselectivity (91–94% ee). Jew and Park later disclosed a 2,3,4‐trifluorobenzyl substituted cinchoninium catalyst, which further improved enantioselectivity (98% ee) [9]. A dicationic, tethered bis‐cinchoninium catalyst was also reported by the same authors as an efficient benzylation catalyst (95% ee) [10, 11].
Читать дальшеИнтервал:
Закладка:
Похожие книги на «Catalytic Asymmetric Synthesis»
Представляем Вашему вниманию похожие книги на «Catalytic Asymmetric Synthesis» списком для выбора. Мы отобрали схожую по названию и смыслу литературу в надежде предоставить читателям больше вариантов отыскать новые, интересные, ещё непрочитанные произведения.
Обсуждение, отзывы о книге «Catalytic Asymmetric Synthesis» и просто собственные мнения читателей. Оставьте ваши комментарии, напишите, что Вы думаете о произведении, его смысле или главных героях. Укажите что конкретно понравилось, а что нет, и почему Вы так считаете.







