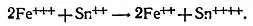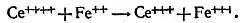Л. — Что я слышу, Незнайкин? Ты просишь меня перейти к количественному определению! Но успокойся, это, впрочем, очень просто. Если свести вместе ионы трехвалентного железа и ионы двухвалентного олова (с двумя положительными зарядами), то ионы трехвалентного железа будут восстановлены до состояния ионов двухвалентного железа, пока остаются ионы двухвалентного олова, которые могут окислиться до ионов четырехвалентного олова (с четырьмя положительными зарядами)
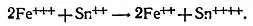
На этот раз реакция необратима, и она продолжается до полного исчезновения одного из исходных компонентов.
И, наоборот, если свести вместе ионы двухвалентного железа и ионы четырехвалентного церия (с четырьмя положительными зарядами), то они будут восстановлены до состояния ионов трехвалентного церия (с тремя положительными зарядами) и полностью окислят ионы двухвалентного железа
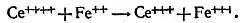
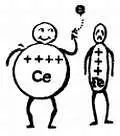
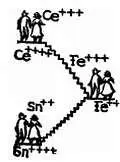
Следовательно, смесь ионов двух- и трехвалентного железа может окислять ионы двухвалентного олова и восстанавливать ионы четырехвалентного церия. Это показывает, что смесь Fe ++/Fe +++более жадна на электроны, чем смесь Sn ++/Sn ++++, но менее жадна, чем смесь Се +++/Се ++++.
Каждую из этих смесей характеризуют потенциалом, который носит название окислительно-восстановительного потенциала и представляет собой просто-напросто разность между потенциалом опущенного в раствор индифферентного электрода и потенциалом этого раствора.
Н. — Почему пользуются индифферентным электродом?
Л. — Чтобы он обменивался с раствором только электронами, но не ионами. Для этого, как правило, берут платину; измеряют разность потенциалов «между платиновой проволочкой и раствором. Измерение производят с помощью эталонного электрода, чаще всего из каломели (рис. 36). Разность потенциалов может быть от —1 в (энергичные восстановители) до +2 в (очень сильные окислители).
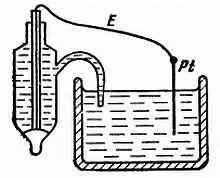
Рис. 36. Для измерения окислительно-восстановительного потенциала раствора в этот раствор впускают индифферентный электрод из платины и эталонный электрод.
Н. — И для этих измерений тебе, естественно, понадобится электрометрический усилитель?
Л. — На этот раз нет. Внутреннее сопротивление электрода из каломели мало, внутреннее сопротивление раствора тоже, и поэтому можно ограничиться хорошим контролером. Но способный на сложную работу может выполнить и более простую, и поэтому обычно пользуются электрометрическим усилителем, который служит для измерения pH.
Н. — Мне в голову пришла идея, она, вероятно, идиотская, но тем не менее я хочу тебе рассказать о ней. По сути дела эти ионы Н +, иначе говоря протоны, жаждут захватить электроны, чтобы вновь стать водородом из порядочной семьи. Нельзя ли рассматривать их как небольшие окислители?

Л. — Они и есть окислители. Воздействие кислоты, иначе говоря ионов Н +, на металл представляет собой реакцию окисления металла. Можно связать теорию окисления с теорией воздействия кислоты, но это увело бы нас слишком далеко от нашей темы. Но ты видишь, насколько расширились твои «допотопные» представления об окислении?
Старые методы измерения pH

Н. — Просто безмерно. Но я полагаю, что показатель pH появился всего лишь несколько лет тому назад: ведь до широкого вторжения в нашу жизнь электроники, которая одна позволяет использовать стеклянный электрод, измерять этот показатель было невозможно.
Л. — И тем не менее это удавалось осуществить. Сначала пользовались красящими веществами, состав и цвет которых изменялись в зависимости от величины pH, как, например, метилоранж (гелиантин), имеющий красный цвет в среде с pH ниже 3 и желтый цвет в среде с pH выше 5. Использовали также так называемый водородный электрод, состоящий из платиновой проволочки, покрытой губчатой платиной и платиновой чернью (порошкообразный металл), на который непрерывно подают газообразный водород. Этот электрод обладает низким внутренним сопротивлением, но он неудобен в работе и чувствителен ко многим вносящим помехи явлениям, от которых свободен стеклянный электрод.
Читать дальше