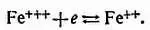Л. — Конечно из обычного нельзя, но ведь я тебе сказал, что для этой цели берут специальное стекло. Но даже такое стекло совершенно не годится для электрической проводки в твоей квартире. Высокое сопротивление стеклянного электрода — большой недостаток этого весьма практичного приспособления. Сопротивление составляет от 50 Мом до нескольких тысяч мегом.
Н. — Иначе говоря, это не проводник, а плохой изолятор. А как измеряют потенциал раствора?
Л. — Для этого в раствор опускают другой, так называемый эталонный электрод, который обычно состоит из цепочки: хлористый калий, хлористая ртуть (каломель), ртуть и платина. Этот каломельный электрод вместе с платиновой проволочкой и стеклянным электродом образуют электрический элемент, э. д. с. которого и замеряют. Электродвижущая сила элемента связана с pH исследуемого раствора линейной зависимостью
E = A+ 0,06· рН,
т. е. изменяется на 60 мв на каждую единицу pH. Постоянная величина А зависит от каломельного электрода и от концентрации известного раствора в колбочке из специального стекла. Завод-изготовитель указывает эту величину в паспорте электродов.
Н. — Значит, нам остается всего лишь измерить электродвижущую силу этой батареи, и дело в шляпе!
Л. — Мне очень нравится твое «всего лишь…» Представь себе, какие проблемы возникают при измерении с точностью лучше 1 мв напряжения на клеммах батареи, внутреннее сопротивление которой может превышать 1000 Мом, Это удается осуществить лишь с помощью специального так называемого электрометрического усилителя.
Н. — Опять!.. Я начинаю думать, что фотоэлемент и электрометрический усилитель представляют собой два краеугольных камня электроники.

Окислительно-восстановительный потенциал

Л. — В нашей следующей беседе мы рассмотрим устройство электрометрических усилителей, которые действительно играют довольно важную роль в электронике. Но прежде чем мы доберемся до них, нам предстоит поговорить еще об одной важной величине в химии растворов — об окислительно-восстановительном потенциале (или о потенциале Редокса). Знаешь ли ты, что такое окислитель?
Н. — Да, в свое время мне объяснили, что окислителями называют вещества, способные выделить кислород или забрать из воды водород, чтобы выделить из нее кислород.
Л. — Приведенное тобой определение было совершенно правильно лет пятьдесят тому назад. Но и сейчас, к сожалению, его можно найти во многих современных книгах. На самом же деле общее и более правильное определение следующее: окислитель в растворе — это ион, который может сообщить другим ионам или атомам положительные заряды (или, вернее, забрать электроны). Так например, ионы железа, лишенные трех электронов и поэтому обладающие тремя положительными зарядами, имеют тенденцию захватить электрон и превратиться в ионы только с двумя положительными зарядами
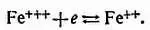

Н. — Почему так? Почему бы им не захватить сразу три электрона и не стать опять порядочным металлическим железом?
Л. — Это тоже возможно, но ионы железа «жаждут» заполучить первый недостающий электрон и в значительно меньшей степени два других. Иначе говоря, ионы двухвалентного железа обладают определенной стабильностью, не свойственной ионам трехвалентного железа. Или, проще говоря, ионы трехвалентного железа голодны на электроны, но, проглотив первый электрон, они изрядно успокаиваются.
Н. — Хорошо, но в твоей формуле содержится еще кое-что, что меня удивляет. Почему реакция обратима?
Л. — Это очень просто, если ионы двухвалентного железа окажутся рядом с более голодным, чем ион трехвалентного железа, «пожирателем электронов» (окислителем), то произойдет реакция в направлении справа налево.
Н. — Мне очень понравилось выражение ионы, «голодные на электроны», но это определение носит скорее качественный характер. Как узнать, что один ион более голоден на электроны, чем другой?
Читать дальше