Л. — Да, если бы я не добавил в воду постороннее вещество. Ну и раз ты находишься на верном пути, скажи мне, какова концентрация ионов Н +в чистой воде.

Н. — Это можно рассчитать. Если | Н +| = | ОН -|, а их произведение равно 10 -14, то концентрация каждого из названных ионов составляет 10 -7.
Л. — Прекрасно. Если теперь я добавлю в воду кислоту, которая высвобождает большое количество ионов Н +, то концентрация ионов ОН -снизится, потому что произведение | Н +| х | ОН -| остается равным 10 -14. Чем больше ионов Н +, тем более выраженный кислотный характер приобретает раствор. Теперь принято измерять количество ионов Н +в растворе и обозначать его логарифмом в сопровождении значка Н +, эту величину называют водородным показателем pH раствора.
Н. — О! Опять логарифмы! Они приводят меня в ужас.
Л. — Все это не так страшно. Запомни только логарифмы некоторых чисел:

Н. — Значит, логарифм всего лишь показатель степени числа 10?
Л. — Видишь, ты сам это понял. Когда говорят, что pH раствора, например, 6, это означает, что концентрация ионов Н +в этом растворе составляет 10 -6. Ты знаешь, что очень чистая вода имеет показатель pH, равный 7. У кислых растворов показатель pH меньше 7…

Н. — Нет, ты ошибаешься! В кислых растворах концентрация ионов Н +выше.
Л. — Подожди, Незнайкин, разве ты не согласен, что 10 -2(или 0,01) все же больше, чем 10 -7(или 0,0000001)?
Н. — Согласен, ты прав. Но скажи, пожалуйста, до какого уровня может опуститься показатель pH в очень кислых растворах?
Л. — При pH = 0 в растворе в каждом литре содержится 1 грамм-ион Н +. А так как концентрация этих ионов может быть немного выше, то величина pH может спуститься несколько ниже нуля — почти до —1.
И наоборот, в основных (или щелочных) растворах, куда добавили ионов ОН -, концентрация ионов Н +опускается ниже уровня 10 -7и может дойти до 10 -14(когда на каждый литр раствора приходится 1 грамм-ион ОН -) и показатель pH может достичь 14.
Иногда показатель может еще повышаться почти до 15, но эти случаи носят скорее характер исключения, чем правила.

Измерение pH
Н. — Но тогда величину pH совершенно невозможно измерить?
Л. — Почему ты думаешь, что при высоких значениях pH, иначе говоря у щелочных растворов, труднее измерить этот показатель?
Н. — Да потому, что даже с помощью точных измерительных приборов невозможно измерить количество ионов, когда в литре их всего лишь 10 -12или того меньше.
Л. — Ты совершенно прав, если пользоваться химическими методами (они бессильны уже при pH = 3). На практике же пользуются электрическими измерениями. Установили, что, когда тонкая перегородка из специального стекла разделяет два раствора с pH соответственно pH 1и рН 2(рис. 35), образуется электрическая батарея, э. д. с. которой примерно равна:
E = E 0+ 0,06·( рН 1 - рН 2),
где Е 0 — постоянная величина, зависящая от нескольких факторов.
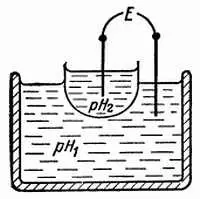
Рис. 35. Разделяя тонкой стеклянной перегородкой (из стекла, с не очень хорошими свойствами изолятора) два раствора с разными pH, вызывают появление разности потенциалов, которая пропорциональна разности pHэтих растворов.
Когда хотят измерить pH какого-нибудь раствора, в него опускают небольшой шарик из специального стекла, в который налит кислый раствор с известным pH и опущена платиновая проволочка. Это приспособление называют стеклянным электродом.

Н. — Любознайкин! Все имеет свой предел, ну, хватит надо мною смеяться! Ведь стекло прекрасный изолятор (к счастью для электронных ламп). Как можно сделать электрод из стекла, которое не проводит электрического тока?
Читать дальше

















