Это было неожиданно. Действительно, квант действия h возник в теории теплового излучения и никаким очевидным образом не был связан ни с атомами, ни с лучами, которые эти атомы испускают. И тем не менее именно он позволил вычислить абсолютные размеры атома и предсказать частоту света, излучаемого им. Угадать эту связь Бору, как и многим до него, помогла глубокая вера в единство природы.
Постулаты Бора (как и всякие постулаты) нельзя обосновывать логически или вывести из более простых. Они остаются произвольными творениями человеческого разума до тех пор, пока опыт не подтвердит следствий, которые из них вытекают. Тогда на их основе развиваются теории, а наиболее удачные из теорий называют законами природы.
Мы ограничимся только этими тремя следствиями теории Бора — на самом деле их значительно больше, и все они демонстрируют непонятную силу непонятных постулатов.

Раздумья Бора
Конечно, Бор пришел к ним несколько другим путем, чем мы с вами сейчас: когда человек впервые поднимается на незнакомую вершину, трудно ожидать, что он идет самым коротким путем. Только взойдя на пик, он видит, как можно было покорить его проще.
Несмотря на необычность постулатов Бора, его теория нашла довольно быстрое признание и достаточно много талантливых и сильных последователей. Если бы потребовалось определить отношение к ней физиков в те годы, то, пожалуй, пришлось бы назвать чувство облегчения, чувство освобождения от того постоянного напряжения, в котором все они до сих пор находились, пытаясь удержать в памяти разрозненные факты и хоть как-то связать концы с концами. Теперь все атомные явления, естественно, группировались вокруг непонятной, но простой модели; часть из них блестяще ею объяснялась, а другая требовала дальнейшего развития модели.
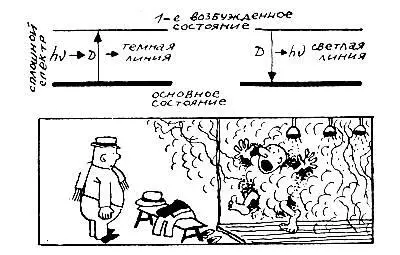
В частности, теперь очень просто можно было объяснить опыт Кирхгофа и Бунзена с парами натрия.
Действительно, пока луч от раскаленного тела не прошел через пары натрия, атомы которого находятся в основном состоянии, он содержит все длины волн. Проходя через пары, луч переводит атом натрия из основного состояния в первое возбуждение. На это затрачивается энергия кванта E = hν, частота которого ν как раз и совпадает с частотой линии D натрия. Поэтому прошедший свет уже не содержит лучей с этой частотой, и на шкале спектрографа мы видим сплошной спектр, перерезанный в желтой части темной линией D.
В обратном процессе, когда атомы натрия переходят из возбужденного состояния в основное, они излучают свет с той же частотой ν, которую прежде поглотили, то есть ту же линию D, но теперь уже ярко-желтую.
Несмотря на все успехи теории Бора, физики вначале принимали ее скорее как удобную модель, но не очень верили в реальность такой энергетической лестницы в атоме. Это сомнение разрешили Джеймс Франк (1882–1964) и Густав Герц (род. 1887) (племянник знаменитого Генриха Герца) в том же 1913 году. Как и всякая ясная идея, теория Бора не только объясняла старые факты, но также подсказывала пути для своей проверки.
Арнольд фон Зоммерфельд (1868–1951) — замечательный физик и блестящий педагог — был одним из первых в Европе, кто сразу же не только поверил в постулаты Бора, но и развил их дальше, «…следуя, как когда-то Кеплер при изучении планетной системы, внутреннему чувству гармонии». Он рассуждал так: если атом подобен солнечной системе, то электрон в такой системе может вращаться не только по окружности, как в модели Бора, но и по эллипсам, причем ядро должно находиться в одном из фокусов этих эллипсов.
Зоммерфельд
Эллипсы с одинаковой большой полуосью принадлежат одному и тому же значению главного квантового числа n, так как энергии электрона на таких орбитах равны между собой (Зоммерфельд знал доказательство, а нам придется поверить в это). Однако эллипсы различаются по степени сплющенности, которая зависит от орбитального момента. Вполне в духе идей Бора Зоммерфельд предположил, что при заданном n эллипсы могут быть сплющены не произвольным образом, а только так, чтобы орбитальное квантовое число l (которое их различает) принимало целые значения l = 0,1,2…. n — 1, то есть число допустимых эллипсов не превышает числа n — номер стационарного состояния.
Читать дальше













