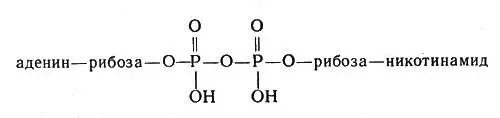В других ферментах, например в тех, которые катализируют гидролитическое разложение белков (пепсин в желудочном соке), активный центр не содержит инородных соединений, а представляет собой просто совокупность отдельных частей длинной цепеобразной молекулы белка, сближенных друг с другом в результате изгиба сложной цепи. Следовательно, активный центр фермента может возникнуть как результат определенной деформации белковой частицы; другими словами, геометрические особенности полипептидной цепочки, из которой белки и состоят, имеют большое значение для проявления каталитических свойств.
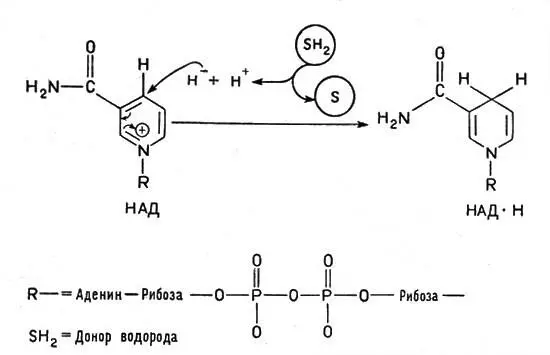
Рис. 2. Превращение окисленной формы кофермента НАД в восстановленную. Водород от окисляемого вещества (субстрата, обозначенного SH 2) переходит к НАД +(на кольцо пиридина в никототинамиде) в виде гидридного иона Н -. Другой ион водорода Н +переходит в окружающую среду
Очень большую роль в обмене веществ играют ферменты, облегчающие перенос водорода, — дегидрогеназы. Они содержат белковую часть и кофакторы. Важнейшим кофактором (коферментом) является так называемый НАД, или никотинамидадениндинуклеотид, молекула которого состоит из сочетания аденина (органическое основание), рибозы (углевод, содержащий пять атомов углерода) и двух остатков фосфорной кислоты, связывающих "мостиком" другой остаток рибозы, соединенный в свою очередь с никотинамидом:
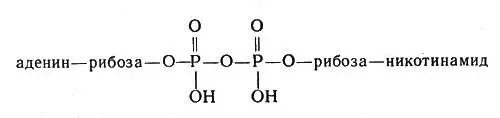
Молекула НАД или никотинамидадениндинуклеотид
Это сложное соединение, связанное с белком, обладает способностью, отнимая от другого вещества водород, присоединять его и передавать дальше следующему переносчику. При этом водородный атом присоединяется к никотинамидному кольцу в виде отрицательного иона Н -, образуя восстановленный НАД — НАД*Н, а второй ион Н +субстрата поступает в окружающую среду. В целом от молекулы субстрата отнимается два атома водорода (рис. 2). Аналогичные функции выполняет и другой кофермент — ФАД, или флавинадениндинуклеотид, построенный так же, но содержащий вместо никотинамида флавиновую группу более сложного строения. Благодаря флавиновой группе ФАД способен восстанавливаться, присоединяя два атома водорода и образуя ФАД*Н 2(рис. 3).
Рис. 3. Восстановление флавинадениндинуклеотида (показана флавиновая часть молекулы ФАД)
Рассмотрим некоторые важные ферменты, в состав которых входит железо.
Каталазы. Ферменты, относящиеся к этой группе, разлагают пероксид водорода на воду и кислород. Широкая распространенность и большая активность, о которой мы упоминали, позволяют обнаружить фермент в различных животных и растительных тканях простейшими средствами.
Достаточно бросить в аптечный раствор пероксида водорода кусочек моркови, картофеля, мяса, как сейчас же будет заметно энергичное выделение пузырьков газа (кислорода) на их поверхности: это действует каталаза. Под влиянием пероксида водорода фермент и сам медленно разлагается, но в слабых растворах (а в клетках концентрация пероксида невелика) каталаза работает долго и энергично, устраняя опасности, связанные для организма с действием такого сильного оксислителя, каким является пероксид [2] Снижение содержания каталазы в эритроцитах ведет к тяжелым болезненным явлениям, например, у человека — к гангрене полости рта (Б. К. Саундерс).
.
Хотя наблюдения подобного рода делались давно, чистую кристаллическую каталазу удалось получить лишь в 1937 г. Молекулярные массы каталаз различного происхождения лежат в пределах 225000-250000; на одну белковую молекулу приходится четыре иона железа.
В процессе взаимодействия каталазы с пероксидом образуется неустойчивое промежуточное соединение зеленого цвета. Именно оно и служит тем важным звеном, которое определяет весь ход каталитического разложения пероксида.
При больших концентрациях пероксида (по Чансу) каталаза образует с пероксидом еще два соединения — одно из них, красного цвета, слабоактивно, а другое вовсе не обладает каталитической активностью.
Промежуточное зеленое соединение реагирует со второй молекулой пероксида по схеме:
Читать дальше