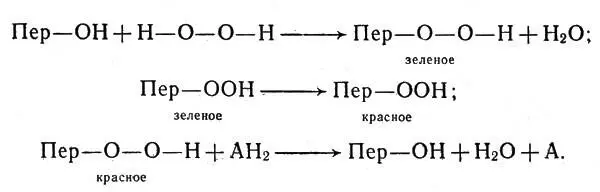Мы переходим теперь к тем случаям участия металлов в действии ферментов, когда ион металла, не образуя прочных комплексов, тем не менее сильно повышает активность фермента, иначе говоря, играет роль активатора.
Ион металла, белок фермента и превращаемая молекула того или иного соединения (субстрат) в процессе реакции образуют различные промежуточные структуры. На рисунке 4 показаны возможные сочетания иона металла (М), субстрата и белка-фермента (Ф). Субстрат играет роль лиганда и обозначен L.
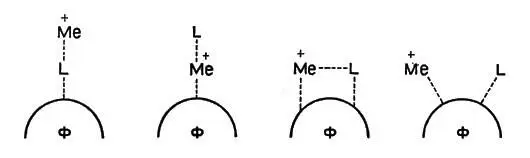
Рис. 4. Возможные сочетания белка (L), иона металла (М) и фермента (Ф)
Ион металла может действовать на лиганд, уже соединенный с белком, может располагаться между ними ("мостик"), может вступать в соединение с другой точкой белковой молекулы. При этом ион металла выполняет в общем случае сразу несколько функций: он поддерживает лиганд (субстрат) и белок в определенном пространственном положении, удобном для реакции, оказывает на связанные с ним молекулы или группы атомов поляризующее действие, смещая в них электроны, и, наконец, он может действовать как катализатор. Различить эти отдельные функции в общем эффекте повышения активности фермента очень трудно, и чаще всего механизм работы активаторов остается спорным.
Доказано, что ионы металлов делают более устойчивой ту форму белковой молекулы фермента (ее активной области), которая проявляет наибольшую каталитическую активность.
Важным ферментом, содержащим ион металла, а именно цинка, является карбоксипептидаза. Карбоксипептидаза вместе с другими ферментами, катализирующими гидролиз, разлагает молекулу пищевого белка на отдельные аминокислоты, из которых потом клетка построит нужные ей белки. Специальность карбоксипептидазы — отщепление аминокислотных остатков от того конца полипептидной цепочки белка, на котором находится карбоксильная группа, например:
Специальность карбоксипептидазы — отщепление аминокислотных остатков от того конца полипептидной цепочки белка, на котором находится карбоксильная группа
R обозначает какой-нибудь радикал, например СН 3. Под влиянием карбоксипептидазы произошло отщепление концевой аминокислоты (в данном случае глицина); к концам разорванной связи присоединились ионы Н+ и ОН- молекул воды, как это вообще происходит при гидролизе пептидных связей NH-СО.
Молекулярная масса карбоксипептидазы 87000; молекула ее состоит из трех субъединиц и включает 307 аминокислотных остатков. Молекула имеет шаровидную форму, на ее поверхности недалеко от иона цинка обнаружены углубления и канал, по-видимому, содержащие молекулы воды и предназначенные для правильного размещения той части белковой цепочки, на которую действует фермент. Активный центр этого фермента построен довольно сложно и содержит большое число аминокислотных остатков, положение которых в настоящее время известно достаточно точно. Ион цинка связан с двумя остатками гистидина и глутаминовой кислоты (рис. 5).
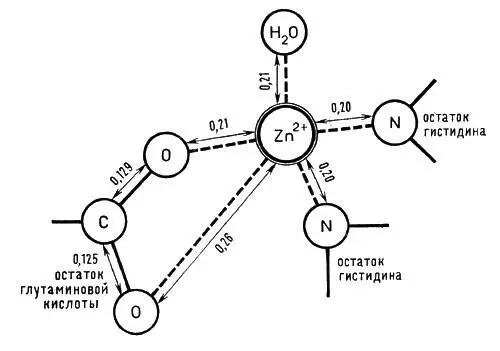
Рис. 5. Строение активного центра фермента карбоксипептидазы (расстояния между атомами даны в нанометрах)
Цинк удается заместить на ионы других металлов: кобальт(II), марганец(II), никель(II), причем получаются активные карбоксипептидазы. Относительная легкость такой замены и образование активных соединений с другими ионами — характерный признак многих случаев активации; здесь специфичность металла менее выражена, чем, например, в гемовых комплексах.
Все эти ионы способствуют связыванию субстрата (т. е. полипептидных белковых цепей) с активными центрами, кроме того, ион металла оттягивает на себя электроны кислорода карбонильной группы С=O (в пептидной связке СО-NH), в результате чего двойная связь между С и О поляризуется и облегчается ее реакция с водой, приводящая к разрыву С-N связи:
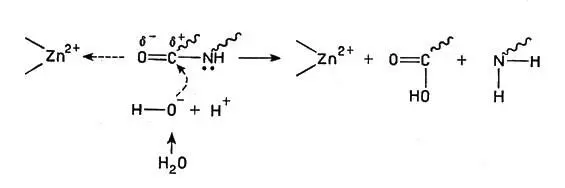
Ион металла оттягивает на себя электроны кислорода карбонильной группы С=O
(волнистая линия — полимерная молекула белка).
Ионы цинка, как мы уже упоминали, входят в состав еще одного фермента, функции которого тесно связаны с дыханием, — карбонангидразы. Этот фермент был выделен из эритроцитов человека и животных и оказался белковым соединением с молекулярной массой около 30000. На одну молекулу фермента приходится один атом цинка. В зависимости от источника получения молекулярная масса несколько колеблется, поэтому считают, что существует несколько видов карбонангидразы (изоферменты).
Читать дальше