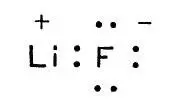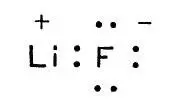
Молекула фторида лития
(При понижении температуры получится кристалл фторида лития, в котором находятся ионы лития и фтора.) В этом простом примере валентность атома лития и атома фтора равна единице. Восемь электронов, окружающих ядро иона фтора, и пара электронов около ядра иона лития, как доказано, образуют очень простое сочетание. Соответственно и хлорид лития — прочное соединение. Опыт и теория показали, что так просто нельзя себе представлять картину образования химических связей во всех случаях. Во-первых, отданный атомом лития электрон не полностью переходит "во владение" атома фтора. Фактически получается пара электронов, область движения которых охватывает оба атома. Во-вторых, химическая связь может образоваться и тогда, когда оба связывающих электрона принадлежат одному атому. Рассмотрим в качестве примера атом азота, вступающий в соединение с тремя атомами водорода. В результате получается молекула NН 3— молекула аммиака; атом азота в ней, очевидно, трехвалентен. Схематически это и отражено в формуле:
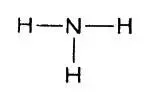
Атом азота, вступающий в соединение с тремя атомами водорода
В атоме азота пять внешних электронов. Три из них использованы для соединения с атомами водорода. Каждый атом водорода отдает по одному электрону для образования пар, связывающих оба атома. Схема электронного строения аммиака выглядит так:
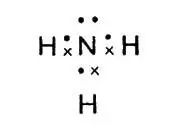
Схема электронного строения аммиака
Здесь электроны, принадлежавшие атомам водорода, условно обозначены крестиками, электроны азота — точками. Легко заметить, что атом азота имеет пару электронов, которая не принимает участия в связывании.
Допустим, что молекулы аммиака попадают в среду, в которой находятся ионы водорода Н +(в раствор какой-либо кислоты). Ионы водорода немедленно присоединяются к свободной паре электронов азота, и получится химическая связь — точно такая же, как и три другие. Однако на этот раз в образовании связи принимали участие электроны не двух атомов, как в предыдущем примере, а только одного! Связи, возникшие таким путем, называются координационными.
А не могут ли сами молекулы аммиака за счет своих свободных электронных пар присоединяться к ионам металлов? Весь вопрос в том, будет ли происходить при этом снижение запаса потенциальной энергии всех частиц, — это ведь обязательное условие образования прочных химических связей.
Развитие идей квантовой механики привело к выводу, что электроны в атомах размещены на определенных энергетических уровнях и переход электрона с одного уровня на другой соответствует скачкообразному изменению запаса энергии атома. Чем больше номер периода, в котором находится элемент, тем больше число уровней в его атоме. На каждом уровне может находиться лишь строго определенное число электронов (на первом уровне два электрона, на втором — восемь, на третьем — восемнадцать и т. д.).
Если число электронов на данном уровне мало (или если на уровне вообще нет электронов, хотя они могли бы там находиться), то другая частица, имеющая свободную (неподеленную) пару электронов, вполне может передать эту пару на свободный (вакантный) уровень.
Ион меди располагает такими свободными уровнями, поэтому четыре молекулы аммиака легко передают ему четыре пары своих электронов, в результате чего и возникают четыре химические связи, соединяющие ион меди с молекулами аммиака, — получается тот самый темно-синий комплексный ион Cu(NH 3) 4 2+, о котором шла речь выше.
В примере с фторидом лития было указано, что электроны, связывающие ионы лития и фтора, образуют общую систему и движутся так, что в своем движении они охватывают оба атома. Квантовая механика ничего не говорит о движении электрона, ее методы позволяют вычислить только вероятность того, что электрон находится в данной части пространства. Поэтому вместо того чтобы рисовать пути движения электрона в атоме или молекуле (траектории или орбиты), ограничиваются геометрическим описанием той области пространства около ядра атома, где вероятность найти электрон достаточно велика. Эта область пространства может иметь форму сферы (s-электроны), или гантели (р-электроны), или розеткообразной фигуры (d-электроны). Часто поэтому говорят об электронных "облаках", когда хотят приближенно представить себе распределение электронных зарядов в атоме или молекуле.
Читать дальше