Молекулы комплексных (координационных) соединении отличаются вполне определенной геометрической структурой. Так, два одинаковых лиганда часто располагаются около иона металла таким образом, что центры иона и частиц-лигандов оказываются на одной прямой. Три лиганда размещаются по углам треугольника, четыре — по углам квадрата или четырехгранника (тетраэдра) шесть — по углам восьмигранника (октаэдра) (рис. 1), восемь — по углам куба. Если лиганды неодинаковы, то геометрические формы могут быть и не совсем правильными (искаженными), но тем не менее лиганды остаются фиксированными в определенных точках пространства вокруг центрального иона. В последнем столбце таблицы 3 указаны характерные геометрические формы некоторых координационных соединений, образующих в растворах ионы с различными КЧ.
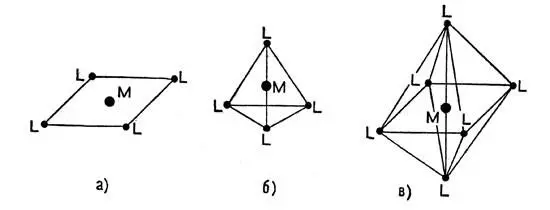
Рис. 1. Расположение лигандов (L) вокруг центрального иона в комплексных соединениях: а — квадрат; б — тетраэдр; в — октаэдр. Центральный ион отмечен буквой М
Геометрическая форма того или иного комплексного иона сохраняется и в том случае, когда вещество выделяют из раствора в виде кристаллов. Следовательно если, например из раствора соли K 2PtCl 6, содержащего ноны К +и [PtCl 6] 2-, выделить кристаллы этой соли то и в кристаллах сохранятся октаэдры (восьмигранники) PtCl 6 2-, т. е. анионы наряду с катионами — ионами калия К +.
Устойчивость геометрической формы комплексного нона ведет к двум важным следствиям.
Во-первых, оказывается, что одно и то же координационное соединение, содержащее лиганды нескольких видов, может существовать в нескольких формах, различающихся способом размещения лигандов и соответственно физическими и химическими свойствами. Так, соединение Pt(NH 3) 2(NO 2)2Cl 2, имеющее лиганды трех сортов, может существовать в пяти различных формах (положение иона платины указано точкой в центре квадрата):
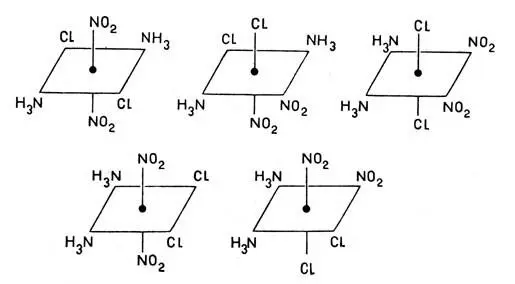
Соединение Pt(NH 3) 2(NO 2)2Cl 2, имеющее лиганды трех сортов, может существовать в пяти различных формах (положение иона платины указано точкой в центре квадрата):
Все пять форм были получены советскими учеными И. И. Черняевым и Г. С. Муравейской. Это явление аналогично явлению изомерии, характерному для органических соединений. Очевидно, все вышенаписанные формулы представляют строение изомеров одного и того же координационного соединения Pt(NH 3) 2(NO 2) 2Cl 2.
Во-вторых, геометрическая форма комплекса влияет на способность центрального иона металла вступать в те или иные взаимодействия с дгими молекулами. Если ион металла имеет координационное число 6 и находится в центре октаэдра, то он, конечно, довольно хорошо изолирован от внешней среды, и молекулам, с которыми о бы вступить в соединение, трудно до него добраться. Но если тот же ион располагается в центре плоского квадрата и имеет КЧ, равное 4, то он открыт с двух сторон. Даже в том случае, когда с одной стороны ион уже присоединил какую-либо частицу (например, частицу белка), все равно с другой стороны к нему открыт доступ.
Именно так обстоит дело с гемоглобином. Комплекс железа с протопорфирином (замещенным порфином) имеет плоское строение, КЧ равно 4. Кроме того, с одной стороны к иону железа присоединена молекула белка (глобин), но шестое место в координационной сфере свободно. Это место и занимает молекула кислорода, переносимого гемоглобином в процессе дыхания. Если бы комплекс железа имел КЧ, равное 6, и ион железа был бы изолирован от среды, гемоглобин не мог бы переносить кислород, необходимый для дыхания клеток.
Как видно, даже геометрические особенности координационных соединений имеют жизненно важное значение. Одной из самых характерных особенностей химии координационных соединений является глубокое различие между свойствами простого иона и иона, окруженного лигандами. Иначе говоря, свойства комплексного иона существенно зависят от химической природы как центрального иона, так и лигандов (табл. 4).
Таблица 4. Сравнение свойств комплексов и гидратированных ионов тех же металлов
Ион металла | Лиганд | Свойство комплексов с данным лигандом | Свойства гидротированного иона
Медь | Аммиак, амины | Реагируют с целлюлозой, темно-синяя окраска; бурно разлагают пероксид водорода | Не реагируют с целлюлозой, слабоголубая окраска; медленно разлагают пероксид водорода
Читать дальше