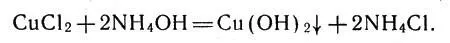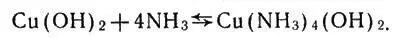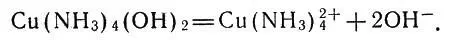Фактически дело обстоит не так, и молекулы воды образуют с ионами металлов разнообразные соединения. Они отличаются рядом характерных свойств, в частности окраской.
Хлорид меди CuCl 2высушенный, т. е. безводный, окрашен в светло-коричневый цвет. Бросим щепотку этой соли в воду, получится раствор голубой окраски. Ионы хлора бесцветны, голубую окраску надо приписать соединению иона меди и молекул воды. Проверим это. Попробуем заменить воду иным растворителем, например ацетоном; если голубая окраска свойственна водному соединению, то в ацетоне должна наблюдаться другая окраска, независимо от того, реагирует ли ион меди с ацетоном или нет. Хлорид меди растворяется в ацетоне, образуя раствор зелено-коричневого цвета. При добавлении в него избытка воды раствор делается голубым. Все это убеждает нас в том, что ионы металла с водой (и, вероятно, с ацетоном) образуют какие-то соединения. Еще Д. И. Менделеев — творец сольватной теории растворов — указывал на бесспорные признаки химической реакции в процессе растворения многих веществ. Измерения обнаруживают и выделение теплоты при растворении безводных солей: безводные хлорид и сульфат меди сильно разогреваются при добавлении к ним воды. С другой стороны, если попробовать удалить воду из раствора сульфата меди, то можно получить красивые синие кристаллы, имеющие состав CuSO 4*5H 2O. Для того чтобы удалить и эти оставшиеся молекулы воды (четыре из них, как доказано, окружают ион меди и одна соединена с сульфат-ионом), придется сильно нагреть кристаллы; тогда они, теряя воду, становятся почти белыми.
Все это позволяет сделать уверенный вывод, что молекулы способны прочно присоединяться к ионам меди, заметно изменяя их свойства, в частности окраску. Молекулы воды присоединяются и к ионам других металлов — кальция, железа, магния, натрия и др. При медленном испарении воды из растворов солей удается получить кристаллы, содержащие соль и определенное количество молекул воды на каждую молекулу соли. Выделенные в чистом виде, такие соединения носят название кристаллогидратов. К кристаллогидратам относят соединения: CuCl 2*2H 2O, CuSO 4*5H 2O, а также СаСl 2*6Н 2O, CaSO 4*2H 2O, Na 2SO 4*10H 2O и др.
Но не только вода, а и другие соединения могут взаимодействовать с ионами металлов в растворах. Добавим, например, к водному раствору какой-либо соли меди (можно взять раствор хлорида СuСl 2) избыток водного аммиака. Сначала появится зеленовато-голубой осадок, затем он быстро исчезнет, а жидкость приобретет красивый темно-синий цвет. Что произошло? Первые порции водного аммиака вступили в реакцию с хлоридом меди, и получился осадок гидроксида меди (II):
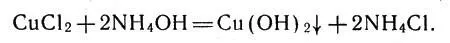
Реакция водного аммиака с хлоридом меди
Растворение осадка и появление синей окраски указывают на развитие другой реакции. В результате взаимодействия гидроксида с молекулами аммиака, которые всегда имеются в водном растворе аммиака, получилось соединение — аммиакат меди:
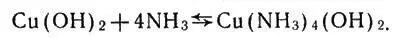
Взаимодействие гидроксида меди с молекулами аммиака
Это соединение способно диссоциировать, отщепляя ионы ОН-:
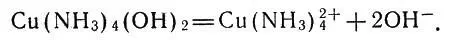
Диссоциация аммиаката меди
Молекулы аммиака прочно связаны с ионами меди, и синяя окраска — это свойство именно комплексного иона Cu(NH 3) 2 4 +. Следовательно, к ионам металлов могут присоединяться не только молекулы воды, но и молекулы других соединений, в частности аммиака.
Обширные исследования таких комплексных молекул и ионов привели ученых к выводу, что комплексообразование представляет собой одно из самых распространенных явлений в химии металлов. Было установлено, что практически ионы всех металлов способны образовывать комплексные соединения с различными молекулами органических и неорганических соединений. Известны, например, следующие соединения: Со(NН 3)6Сl 2, Pt (NH 3)Cl 2, Сr(NН 3)6Сl 3, [NiEn 3]Cl 2и др. (Символ Еn обозначает молекулу этилендиамина H 2N — CH 2— СН 2— NH 2.) Прочно связанные молекулы аммиака или этилендиамина в этих соединениях размещены в непосредственной близости от центрального иона металла — их называют лигандами (что значит "связанные").
Лиганды могут нести электрический заряд, т. е. быть ионами. В таких случаях заряд всего комплексного иона получается алгебраическим суммированием заряда всех лигандов и заряда центрального иона. Примером может служить комплексное соединение иона железа (II) с цианид-ионами CN -. Комплекс [Fe(CN) 6] 4-имеет отрицательный заряд, так как центральный ион заряжен двумя положительными, а шесть ионов-лигандов несут шесть отрицательных зарядов. Комплексный ион может удерживать четыре однозарядных катиона, например четыре иона калия. Выделенная из раствора комплексная соль имеет состав K 4[Fe(CN) 6].
Читать дальше