Feynmann - Feynmann 9
Здесь есть возможность читать онлайн «Feynmann - Feynmann 9» весь текст электронной книги совершенно бесплатно (целиком полную версию без сокращений). В некоторых случаях можно слушать аудио, скачать через торрент в формате fb2 и присутствует краткое содержание. Жанр: Старинная литература, на английском языке. Описание произведения, (предисловие) а так же отзывы посетителей доступны на портале библиотеки ЛибКат.
- Название:Feynmann 9
- Автор:
- Жанр:
- Год:неизвестен
- ISBN:нет данных
- Рейтинг книги:3 / 5. Голосов: 1
-
Избранное:Добавить в избранное
- Отзывы:
-
Ваша оценка:
- 60
- 1
- 2
- 3
- 4
- 5
Feynmann 9: краткое содержание, описание и аннотация
Предлагаем к чтению аннотацию, описание, краткое содержание или предисловие (зависит от того, что написал сам автор книги «Feynmann 9»). Если вы не нашли необходимую информацию о книге — напишите в комментариях, мы постараемся отыскать её.
Feynmann 9 — читать онлайн бесплатно полную книгу (весь текст) целиком
Ниже представлен текст книги, разбитый по страницам. Система сохранения места последней прочитанной страницы, позволяет с удобством читать онлайн бесплатно книгу «Feynmann 9», без необходимости каждый раз заново искать на чём Вы остановились. Поставьте закладку, и сможете в любой момент перейти на страницу, на которой закончили чтение.
Интервал:
Закладка:
Поскольку разные l -состояния обладают разными энергиями, то каждое значение l отвечает некоторой подоболочке из 2(2 l +1) возможных состояний (с различными т и различными направлениями спина). У всех у них энергия одинакова с точностью до некоторых слабых эффектов, которыми мы пренебрежем.
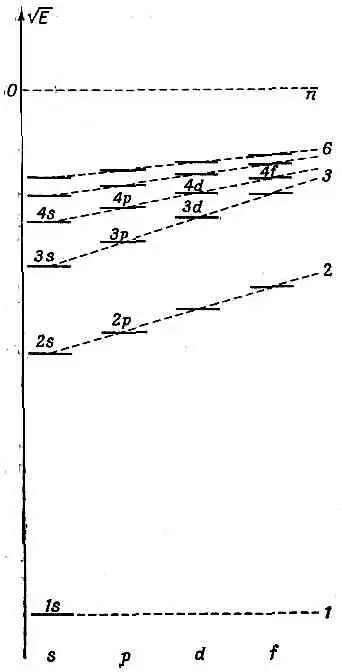
Фиг. 17.8. Схематическая диаграмма уровней анергии атомного электрона в присутствии других электронов. Масштаб иной, нежели па фиг. 17.7.
Значит, в атоме лития два электрона будут в 1 s -состояниях, а один — в 2 s -состоянии. Поскольку электрон в 2 s -состоянии обладает более высокой энергией, чем электрон в 1s-состоянии, то его сравнительно легко удалить. Ионизационная энергия лития всего 5,4 эв, и он весьма активен химически.
Так постепенно перед вами развертывается вся картина; в табл. 17.2 мы привели список первых 36 элементов, отметив состояния, занимаемые электронами в основном состоянии каждого атома. Таблица дает энергию ионизации для наиболее слабо связанного электрона и количество электронов, занимающих каждую «оболочку», т. е. состояние с одним и тем же п.
Таблица 17.2 · ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ ПЕРВЫХ
36 ЭЛЕМЕНТОВ (число электронов в разных состояниях)
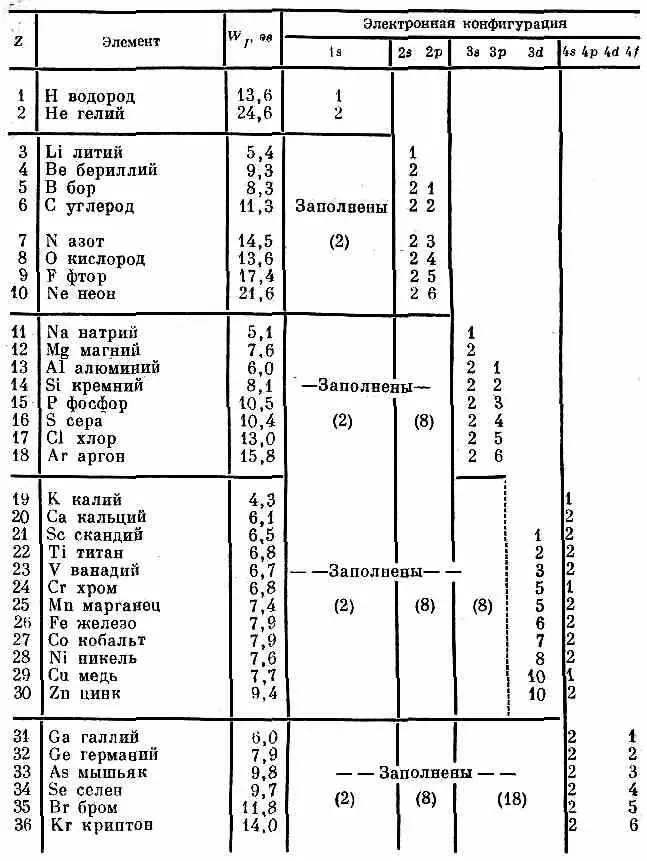
Поскольку разные l -состояния обладают разными энергиями, то каждое значение l отвечает некоторой подоболочке из 2(2 l +1) возможных состояний (с различными m и различными направлениями спина). У всех у них энергия одинакова с точностью до некоторых слабых эффектов, которыми мы пренебрежем.
Бериллий похож на литий, только у него в 2 s -состоянии находятся два электрона, а в заполненной 1s-оболочке тоже два.
От В до Ne
У бора 5 электронов. Пятый должен уйти в 2 p -состояние. Всего бывает 2x3 = 6 разных 2 p -состояний, поэтому можно продолжать добавлять по электрону, пока не дойдем до 8. Так мы доберемся до неона. Добавляя эти электроны, мы увеличиваем также Z , поэтому все электронное распределение все теснее и теснее стягивается к ядру и энергия 2 p -состояний все снижается и снижается, К тому времени, когда мы достигнем неона, энергия ионизации возрастет до 21,6 эв. Неон легко своего электрона не отдает. У него к тому же больше нет пустых мест на орбите, которые можно заполнить, так что и чужие электроны ему не нужны. Стало быть, неон химически инертен. У фтора есть пустое место, попав на которое, электрон может оказаться в состоянии с низкой энергией, поэтому в химических реакциях фтор очень активен.
От Na до Ar
В натрии одиннадцатый электрон вынужден начать новую оболочку, переходя в 3 s -состояние. Уровень энергии этого состояния намного выше; энергия ионизации резко спадает; натрий химически очень активен. От натрия до аргона s - и p -состояния с n =3 заполняются в той же последовательности, как от лития до неона. Угловые конфигурации электронов во внешней незаполненной оболочке идут в той же последовательности, и прогрессирующий рост энергии ионизации тоже весьма схож с тем, что было раньше. Вы теперь понимаете, почему химические свойства с ростом атомного числа повторяются. Химическое действие магния очень похоже на бериллий, кремния — на углерод, хлора — на фтор. Аргон, подобно неону, инертен. Быть может, вы уже обратили внимание на то, что в последовательности энергий ионизации от лития до неона есть небольшая особенность, и такая же особенность наблюдается между натрием и аргоном. Последний электрон прикреплен к атому кислорода чуть слабее, чем можно было ожидать. Тем же самым отличается сера. Отчего бы это? Это можно понять, если чуть внимательнее вдуматься в эффекты взаимодействия между электронами. Подумаем о том, что бывает, когда мы помещаем в атом бора первый 2 p -электрон. Он имеет шесть возможностей — три возможных р -состояния, в каждом по два спина.
Представим, что электрон со спином вверх попадает в состояние с m = 0, которое мы также будем называть « z »-состоянием, потому что оно облегает ось z . Ну, а что произойдет в углероде? Теперь уже 2 p -электронов два. Если один из них попал в « z »-состояние, то куда попадет второй? Ниже всего его энергия будет тогда, когда он расположится подальше от первого электрона. Этого можно достичь, попав, скажем, в « x »-состояние 2 p -оболочки. (Это состояние, как вы помните,— просто линейная комбинация состояний с m = + 1 и с m = - 1.) Дальше, когда мы перейдем к азоту, то у тройки 2 p -электронов наименьшая энергия взаимного отталкивания будет тогда, когда один из них попадет в « x »-конфигурацию, другой — в «у», третий — в «z». Весь этот хоровод, однако, для кислорода не проходит. Четвертому электрону уже ничего не остается, как попасть в одно из заполненных состояний, держа при этом спин вниз. Тот электрон, который уже находится в этом состоянии, начнет его сильно отталкивать, так что его энергия не будет такой низкой, какой она была бы в противном случае, поэтому его легче будет удалить. Этим и объясняется разрыв в последовательности энергий связи, который появляется между азотом и кислородом, и между фосфором и серой.
Читать дальшеИнтервал:
Закладка:
Похожие книги на «Feynmann 9»
Представляем Вашему вниманию похожие книги на «Feynmann 9» списком для выбора. Мы отобрали схожую по названию и смыслу литературу в надежде предоставить читателям больше вариантов отыскать новые, интересные, ещё непрочитанные произведения.
Обсуждение, отзывы о книге «Feynmann 9» и просто собственные мнения читателей. Оставьте ваши комментарии, напишите, что Вы думаете о произведении, его смысле или главных героях. Укажите что конкретно понравилось, а что нет, и почему Вы так считаете.












