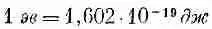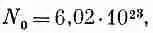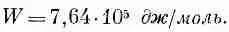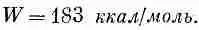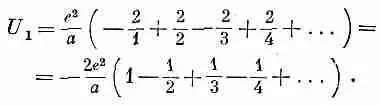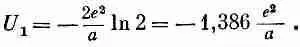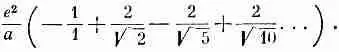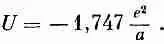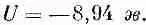
Если наше представление о системе правильно, мы должны уметь проверить его, задав следующий вопрос: сколько понадобится энергии, чтобы разбросать эти ионы, т. е. полностью разделить кристалл на ионы? Эта энергия должна быть равна теплоте испарения соли плюс энергия, требуемая для диссоциации молекул на ионы. Полная энергия разделения NaCl на ионы, как следует из опыта, равна 7,92 эв на молекулу.
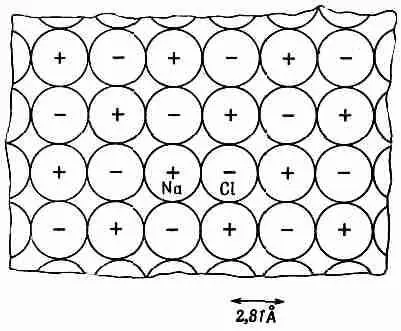
Фиг. 8.5. Поперечный разрез кристалла соли в масштабе нескольких атомов.
В двух перпендикулярных к плоскости рисунка сечениях будет такое же шахматное расположение ионов Na и Сl (см. вып. 1, фиг. 1.7).
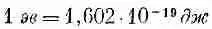
Пользуясь коэффициентом перевода
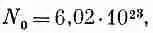
и числом Авогадро (количество молекул в грамм-молекуле)
можно представить энергию испарения в виде
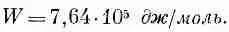
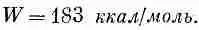
Излюбленная единица энергии, которой пользуются физико-химики,— килокалория, равная 4190 дж ; так что 1 эв на молекулу — это все равно что 23 ккал/моль. Химик сказал бы поэтому, что энергия диссоциации NaCl равна
Можем ли мы получить эту химическую энергию теоретически, подсчитывая, сколько работы понадобится для того, чтобы распотрошить кристалл? По нашей теории она равна сумме потенциальных энергий всех пар ионов. Проще всего составить себе представление об этой энергии, выбрав какой-то один ион и подсчитав его потенциальную энергию по отношению ко всем прочим ионам. Это даст удвоенную энергию на один ион, потому что энергия принадлежит парам зарядов. Если нам нужна энергия, связанная с одним каким-то ионом, то мы должны взять полусумму. Но на самом деле нам нужна энергия на молекулу, содержащую два иона, так что вычисляемая нами сумма прямо даст нам энергию на молекулу.
Энергия иона по отношению к его ближайшему соседу равна —e 2/a, где e 2 = q 2 e /4pe 0, а а — промежуток между центрами ионов. (Мы рассматриваем одновалентные ионы.) Эта энергия равна —5,12 эв; мы уже видим, что ответ получается правильного порядка величины. Но нам еще предстоит подсчитать бесконечный ряд членов.
Начнем со сложения энергий всех ионов, лежащих по прямой. Считая ион, отмеченный на фиг. 8.5 значком Na, нашим выделенным ионом, сперва рассмотрим те ионы, которые лежат на одной с ним горизонтали. Там есть два ближайших к нему иона хлора с отрицательными зарядами, на расстоянии я от Na каждый. Затем идут два положительных иона на расстояниях 2а и т. д. Обозначая эту сумму энергий U 1 , напишем
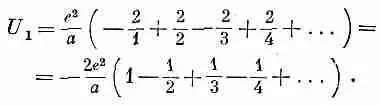
(8.19)
Ряд сходится медленно, так что численно его оценить трудно,
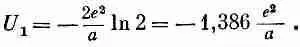
но известно, что он равен ln2. Значит,
(8.20)
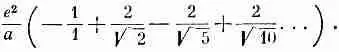
Теперь перейдем к ближайшей линии, примыкающей сверху. Ближайший ион отрицателен и находится на расстоянии а. Затем стоят два положительных на расстоянияхЦ2а. Следующая пара — на расстоянии Ц5а, следующая— наЦ10а и т. д. Для всей линии получается ряд
(8.21)
Таких линий четыре: выше, ниже, спереди и сзади. Затем имеются четыре линии, которые являются ближайшими по диагонали, и т. д. и т. д.
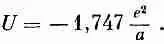
Если вы терпеливо произведете подсчеты для всех линий и затем все сложите, то увидите, что итог таков:
Это число немного больше того, что было получено в (8.20) для первой линии. Учитывая, что е 2 /а= - 5,12 эв, мы получим
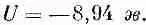
Наш ответ приблизительно на 10% больше экспериментально наблюдаемой энергии. Он показывает, что наше представление о том, что вся решетка скрепляется электрическими кулоновскими силами, в основе своей правильно. Мы впервые получили специфическое свойство макроскопического вещества из наших познаний в атомной физике. Со временем мы добьемся гораздо большего. Область науки, пробующая понять поведение больших масс вещества на языке законов атомного поведения, называется физикой твердого тела.
Читать дальше