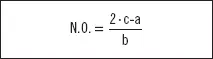Ejemplo
Fórmula del ácido pirosulfúrico o ácido disulfúrico. Se parte de la molécula de ácido sulfúrico (H2SO4), se multiplica dicha molécula por 2 y se le resta una molécula de agua:
2 H 2SO 4– H 2O = H 2S 2O 7
A continuación, se escribe la forma de nombrar estos compuestos en su formas de nomenclatura:
1 Sistemática: leyendo de derecha a izquierda se escribe un prefijo indicando el número de átomos de oxígeno que hay en la molécula + terminación –oxo + raíz de nombre del no metal + terminación –ato + (valencia en números romanos del no metal) + de hidrógeno.
2 Tradicional: ácido + prefijo (hipo-, per-) si corresponde + raíz del nombre del no metal + sufijo –ico u –oso, en función del NO con el que actúa en no metal.
Dado un ácido de la forma H aN bO c(siendo N el no metal), para determinar el N.O. de N, se hace uso de la siguiente relación:
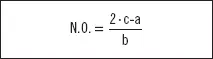

Ejemplo
HClO (Monoxoclorato (I) de hidrógeno; ácido hipocloroso).
Son compuestos formados por la unión del anión OH –y un catión metálico.
La fórmula química de los hidróxidos es de la forma M (OH)m(m: valencia del metal), donde M en el símbolo químico del metal.
A continuación, se escribe la forma de nombrar estos compuestos en sus formas de nomenclatura:
1 Sistemática: prefijo indicando el número de grupos OH – que hay en la molécula + hidróxido + nombre del metal.
2 Stock: hidróxido de + nombre del metal + (valencia en números romanos del metal, si tiene más de una).
3 Tradicional: hidróxido + raíz del nombre del metal + terminación -ico u –oso.

Ejemplo
Fe(OH) 3(Trihidróxido de hierro; hidróxido de hierro (III); hidróxido férrico).
Ca(OH) (Monohidróxido de calcio; hidróxido de calcio; hidróxido cálcico).
Las sales son compuestos iónicos formados por la unión de un catión y un anión, que no sean OH -, O 2-o H -, ya que con estos iones se forman los hidróxidos, óxidos e hidruros, respectivamente.
Iones
Dentro de los iones se distinguen entre los iones con carga positiva denominados cationesy los iones con carga negativa denominados aniones,los cuales se estudian a continuación.
Cationes (iones con carga positiva)
La nomenclatura sería la siguiente:
1 Sistemática: catión + nombre del elemento + (valencia en números romanos, si el elemento tiene más de una).
2 Tradicional: catión + raíz del nombre del elemento + sufijo –ico u –oso, indicando la mayor o menor valencia, respectivamente. Si solo tiene una se usa el sufijo –ico.

Ejemplo
Ca 2+(Catión calcio; catión cálcico).
Fe 2+(Catión hierro (II); catión ferroso).
Los cationes poliatómicos protonados se nombran con la palabra catión(o ión) + raíz del nombre del elemento del que proceden + terminación –onio.Estos cationes proceden de la unión de un protón con un hidruro no metálico.

Ejemplo
NH 4+ (ión amonio, es una excepción ya que debería de ser nitronio); PH 4+ (ión fosfonio); H 3S+ (ión sulfonio); H 3O+ (ión oxonio), etc.
Aniones (iones con carga negativa)
Ahora se mostrará la forma de nombrar a los aniones, donde se hace distinción entre aniones procedentes de elementos no metálicos y aniones procedentes de ácidos oxoácidos.
1 Aniones procedentes de elementos no metálicos: anión + raíz del nombre del elemento + terminación –uro. Ejemplo: Cl – (anión cloruro); Br – (anión bromuro), etc.
2 Aniones procedentes de ácidos oxoácidos (estos aniones proceden del oxoácido correspondiente, el cual ha perdido sus hidrógenos):Sistemática: anión + prefijo indicando el número de átomos de oxígeno que hay en la molécula + terminación –oxo + raíz del nombre del no metal + terminación –ato + (valencia en números romanos del no metal).Tradicional: anión + igual que el ácido pero cambiando las terminaciones –ico por –ato y –oso por –ito.

Ejemplo
NO 3 –(Anión trioxonitrato (V); anión nitrato).
SO 3 2–(Anión trioxosulfato (IV); anión sulfito).
Sales ternarias
Son compuestos iónicos formados por la unión de un catión metálico y el anión procedente de un oxoácido, denominado anión oxoácido.
Para obtener la fórmula química de las sales terniarias se ha de seguir dos pasos:
1 En primer lugar, hay que identificar el ácido del cual proviene, teniendo en cuenta que la terminación –ato viene de –ico y la terminación –ito de –oso.
2 En segundo lugar, obtener el anión correspondiente e intercambiar las valencias con el catión metálico, dando lugar a la sal correspondiente.

Ejemplo
Formular el sulfato férrico:
1 Procede del ácido sulfúrico (–ato à – ico): H2SO4
2 H2SO4 →
2 H ++ SO 4 2–; Fe 3++ SO 4 2–→ Fe 2(SO 4) 3
A continuación, se expone la forma de nombrar estos compuestos en sus formas de nomenclatura:
1 Sistemática: prefijo indicando el número de átomos de oxígeno que hay en la molécula + terminación –oxo + raíz del no metal + terminación –ato (valencia en números romanos del no metal) + de + nombre del metal + (valencia en números romanos del metal, si tiene más de una).
2 Tradicional: prefijo per– o hipo–, si corresponde + raíz del nombre del no metal + terminación –ato o –ito + raíz del nombre del metal + terminación –ico u –oso.
A veces, la fórmula está simplificada, entonces hay que probar con todas las posibles valencias del metal. Solo una de ellas hace que el ácido del que proviene sea correcto.
Читать дальше