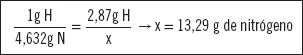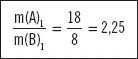Halle la cantidad de NH3 que se obtiene a partir de 2,87 g de hidrógeno.
SOLUCIÓN
Según la ley de proporciones definidas, se establece la siguiente relación:
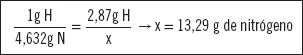
por tanto, la cantidad de amoníaco que se obtiene es
13,29 + 2,87 = 16,16 g de NH 3

Aplicación práctica
Se tienen dos compuestos, ambos formados por dos elementos genéricos A y B. El primero de ellos tiene 18 g del elemento A por cada 26 g del compuesto y el segundo tiene una composición del 75% de A y un 25% de B. Compruebe si se cumple la ley de proporciones múltiples o de Dalton.
SOLUCIÓN
En el primer compuesto si la masa del compuesto es de 26 g y la masa del elemento A que lo conforma es de 18 g, la masa del elemento B es la diferencia:
m(B) = 26 – 18 = 8 g. Por tanto, la relación másica entre los dos elementos que forman el compuesto es
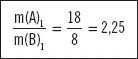
En el segundo compuesto se tiene una composición centesimal de los elementos A y B que lo forman, por tanto, si se toma una cantidad de 100 g de compuesto, 75 g son del elemento A (75%) y 25 g del elemento B (25%). Por lo que la relación másica entre ellos es

es decir,

cumpliéndose la ley de proporciones múltiples o de Dalton.

Aplicación práctica
Un chico va a la joyería a comprarle un anillo de oro blanco a su novia, el cual contiene dos elementos, oro (Au) y plata (Ag). El dependiente tiene dos piezas, que se diferencian en las cantidades relativas de oro y plata que contienen respectivamente, pero ambas tienen una composición uniforme. ¿Cómo se clasificaría entonces el oro blanco?
SOLUCIÓN
El oro blanco tiene una composición uniforme, por lo que se trata de una mezcla homogénea, pero su composición en una pieza y otra es distinta, por lo que no se trata de un compuesto, por tanto, se puede concluir que el oro blanco es una disolución sólida.
2.3. Propiedades generales y específicas de la materia
En este apartado se detallan las propiedades generales y específicas de la materia.
Propiedades generales de la materia
Las propiedades generales de la materia son aquellas que varían según la cantidad de materia que se esté considerando. Estas propiedades son, por ejemplo, el peso, el volumen ocupado, la densidad (relación entre la masa de la materia y el volumen que ocupa), etc.
Propiedades específicas de la materia
Las propiedades específicas de la materia son aquellas que no varían según la cantidad de materia que se esté considerando, y dentro de ellas se distinguen, a su vez, dos grandes grupos: las propiedades físicas y las propiedades químicas.
Las propiedades físicasson aquellas que tienen las sustancias sin cambiar su identidad ni alterar su composición. Ejemplos de estas propiedades son el color, el olor, el brillo, la dureza, la densidad, el punto de fusión (temperatura a la cual pasa de estado sólido a líquido), el punto de ebullición (temperatura a la cual pasa de estado líquido a sólido), etc.
Las propiedades químicasson aquellas que describen la forma en que una sustancia se transforma en otra. Ejemplos de estas propiedades son el mayor o menor grado de oxidación que puede experimentar una sustancia, la inflamabilidad, es decir, la capacidad que tiene una sustancia para arder en presencia de oxígeno, etc.
Al igual que se habla de propiedades físicas y químicas, se puede hablar de cambios físicos y químicos. Los cambios físicos son aquellos que hacen cambiar los estados físicos de la sustancia pero no la composición de la misma.

Ejemplo
Ejemplos de estos cambios físicos son los cambios de estado de la materia, es decir, el paso de gas a líquido, de líquido a sólido y de sólido a gas o viceversa.
Por su parte, los cambios químicos o reacciones químicas son procesos mediante los cuales las sustancias sí cambian su composición transformándose en otras distintas. Un ejemplo de este tipo de cambio es el que sufre un combustible cuando se hace reaccionar con oxígeno, proceso de combustión en el cual se obtiene anhídrido carbónico (CO 2) y agua (H 2O), aunque el objetivo de este tipo de reacciones sea la obtención de energía liberada en el proceso.
2.4. Operaciones de separación de componentes en mezclas
Entre los métodos más comunes usados, tanto en laboratorio como a nivel industrial, para separar los componentes de una mezcla se encuentran los siguientes:
1 Decantación.
2 Separación magnética.
3 Filtración.
4 Cristalización.
5 Destilación.
Decantación
Este método de separación se emplea para separar mezclas formadas por sólidos y líquidos o por dos o más líquidos inmiscibles, es decir, no solubles. Consiste en dejar reposar el líquido que contiene las partículas sólidas en suspensión, de forma que estas caigan al fondo por su mayor densidad. Luego se transvasa con cuidado el líquido, que es menos denso, a otro recipiente, haciendo uso si es necesario de una varilla de vidrio con objeto de retener aquellas partículas sólidas que traten de pasar.
Para separar líquidos inmiscibles, como por ejemplo el agua y el aceite, se usa lo que se denomina un embudo de separación o de decantación, de modo que se coloca en el embudo la mezcla y cuando se halla diferenciada la interfase entre los dos líquidos, se abre la llave y se separan. El que queda en la parte superior es el líquido menos denso (aceite) y permanece dentro del embudo, mientras que el más denso (agua) es recogido en la parte inferior en un matraz Erlenmeyer.

Embudo y matraz
Читать дальше