Modelo atómico de Bhor - Sommerfeld
Sommerfeld introduce los siguientes conceptos nuevos con respecto al modelo de Bhor:
1 Las órbitas descritas por los electrones, denominadas subacapas, dentro de cada nivel energético definido por el número cuántico principal, pueden ser circulares o elípticas, lo que supone pequeñísimas diferencias en los estados energéticos de los electrones. El número cuántico secundario “l”, indica el subnivel energético para cada nivel cuántico, n. Los valores que puede tomar el número cuántico secundario van desde 0 hasta (n−1) y por tradición se identifica a cada subcapa con una letra:
2 El número cuántico magnético “m” indica la orientación en el espacio de las distintas órbitas y su inclinación respecto de un plano de referencia y puede tomar valores desde −l hasta +l, pasando por 0. Por tanto:En una subcapa s solo puede haber un orbital.(m = 0)En una subcapa p se tienen tres orbitales.(m = -1, m = 0, m = + 1)En una subcapa d se tienen cinco orbitales.(m = -2, -1, 0, 1, 2)En una subcapa f se tienen siete orbitales.(m = -3, -2, -1, 0, 1, 2, 3)
3 Se introduce también el concepto de número cuántico de spin “s”, que define el movimiento de rotación del electrón, pudiendo realizarse este en dos sentidos (en el de las agujas del reloj o en el contrario). El número cuántico de spin puede tomar dos valores:

Aplicación práctica
Dados los siguientes grupos de números cuánticos (n, l, m): (3, 2, 0); (2, 3, 0); (3, 3, 2); (3, 0, 0); (2, -1, 1); (4, 2, 0); indique cuáles no son permitidos y por qué.
SOLUCIÓN
1 El (2, 3, 0), ya que si el número cuántico principal es n = 2, el número cuántico l = 3 no está permitido, ya que solo puede tomar valores entre 0 y (n – 1).
2 El (3, 3, 2), ya que si el número cuántico principal es n = 3, el número cuántico l = 3 no está permitido, ya que solo puede tomar valores entre 0 y (n – 1).
3 El (2, -1, 1) ya que si el número cuántico principal es n = 2, el número cuántico l = -1 no está permitido, ya que solo puede tomar valores entre 0 y (n – 1).
6. Configuración electrónica de los elementos
Consiste en indicar la distribución de los electrones que tiene un átomo de un elemento. Para ello, se sigue un orden de llenado de los electrones, para alcanzar el estado de máxima estabilidad posible, esto es, un estado en el que los electrones tienen la menor energía posible, por tanto, intentarán ocupar primero los orbitales con menor energía. El orden de llenado de los electrones se establece con una serie de reglas y principios, que son:
1 Regla de Hund: los electrones se distribuyen en el átomo de menor a mayor energía ocupando primero los orbitales más cercanos al núcleo y dentro de una misma subcapa; los electrones comienzan a colocarse uno en cada orbital, de forma que cuando ya no quedan más orbitales libres, rellenan los que tenían un electrón.
2 Principio de exclusión de Pauli: en un átomo, no se puede tener dos electrones con los cuatro números cuánticos iguales.
3 Regla de Möeller: resume el orden de energía de los orbitales e indica cuáles serán ocupados antes.
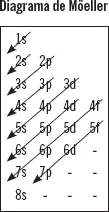
Se van indicando por orden los distintos orbitales ocupados por electrones y el número de electrones que tienen, siguiendo la regla de Möeller. Se termina de llenar cuando se llega al número total de electrones que corresponde a ese elemento (indicado por el número atómico). Se recuerda que:
1 Un orbital s admite como máximo 2 e–.
2 Un orbital p admite como máximo 6 e–.
3 Un orbital d admite como máximo 10 e–.
4 Un orbital f admite como máximo 14 e–.

Ejemplo
Determinar la configuración electrónica de los siguientes elementos, cuyos número atómicos se facilitan entre paréntesis: H (Z = 1); C (Z = 6); Rb (Z = 37)
H : 1s 1
C : 1s 22s 22p 2
Rb : 1s 22s 22p 63s 23p 64s 23d 104p 65s 2
Se dice que dos o más átomos o iones son isoelectrónicossi tienen el mismo número de electrones, como por ejemplo el Cl -(su número atómico es 17, pero su carga 1- indica que ha ganado un electrón, por tanto, tiene 18 electones) y el K +(su número atómico es 19, pero su carga 1+ indica que ha perdido un electrón, por tanto tiene 18 electrones). Las especies isoelectrónicas tienen la misma configuración electrónica.

Nota
Al ión se le suman electrones si es un anión (carga negativa) o se restan si es un catión (carga positiva). Na + (Z = 11, pero pierde un electrón): 1s 22s 22p 6. Cl – (Z = 17, pero gana un electrón): 1s 22s 22p 63s 23p 6.

Aplicación práctica
Escriba las configuraciones electrónicas del átomo e iones siguientes: Al (Z = 13); Na+ (Z = 11); O2– (Z = 8) e indique cuál de ellos son isoelectrónicos.
SOLUCIÓN
El Na +tiene número atómico 11, pero su carga 1+ indica que ha perdido un electrón, por tanto tiene 10 electrones y el O 2–tiene un número atómico de 8, pero ha ganado 2 electrones tal y como indica su carga 2–, por tanto el Na +y el O 2–son isoelectrónicos con 10 electrones cada uno. Las configuraciones electrónicas de cada elemento siguiendo el diagrama de Möeller son:
1 Al : 1s22s22p63s23p1
2 Na+ : 1s22s22p6
3 O2– : 1s22s22p6
7. Propiedades periódicas
Como se ha mencionado en apartados anteriores, los elementos químicos se clasifican y ordenan en la tabla periódica según sus propiedades, la cuales son las que se describen a continuación.
El tamaño o radio de un átomo viene determinado por el tamaño de la corteza electrónica. Fundamentalmente, depende de dos factores:
1 El número de capas que posee el átomo, que viene determinado por número cuántico principal (n); de forma que cuanto mayor sea este número, mayor es el radio del átomo. Al bajar en un mismo grupo (columna), los electrones externos pasan más tiempo lejos del núcleo, lo que hace que aumente el tamaño del átomo, por tanto, el radio atómico aumenta al desplazarse de arriba hacia abajo en un mismo grupo.
2 La carga nuclear efectiva, que es la responsable de atraer a los electrones, incluidos lo más externos, hacia el núcleo. Cuanto mayor sea dicha carga, mayor es la atracción y, por tanto, menor es el radio del átomo, por tanto, dentro de un mismo período (fila) el radio atómico disminuye al desplazarse de izquierda a derecha.

Ejemplo
Ordenaremos los siguientes átomos de menor a mayor radio atómico: P (Z = 15); S (Z = 16); As (Z = 33); Se (Z = 34).
El fósforo (P) y el azufre (S) se encuentran en el mismo período, situándose el S a la derecha del P, por tanto cabe esperar que el radio atómico del primero sea menor que el del P (se recuerda que el radio atómico aumenta de derecha a izquierda). Con el mismo razonamiento se espera que el radio atómico del selenio (Se) sea menor que el del arsénico (As). A su vez, el P y el As se encuentran en el mismo grupo, así como el S y el Se, por tanto, se espera que los radios atómicos del P y S sean menores que los de As y Se, respectivamente (se recuerda que el radio atómico aumenta conforme se baja en un mismo grupo).
Читать дальше
















