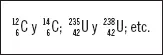Es conveniente definir qué se entiende por átomo y por molécula. Un átomoes la unidad fundamental de un elemento químico, el cual es indivisible si es sometido a cualquier proceso químico, manteniendo su indentidad y propiedades sin variar. Por su parte, una moléculaes una entidad estable y con carga neutra, resultado de la unión entre dos o más átomos.

Sabía que...
A lo largo de la historia los científicos han intentado explicar cuál es la estructura interna de los átomos, es decir, de qué partículas están formados y cómo se distribuyen en su interior.
La teoría atómica nace de manos de un profesor inglés llamado John Dalton entre 1803 y 1808, quien, tras una serie de observaciones y análisis de los átomos de distintos elementos, planteó los siguientes postulados:
1 Cada elemento se compone de partículas extremadamente pequeñas llamadas átomos.
2 Todos los átomos de un elemento dado son idénticos, por lo que los átomos de elementos diferentes son diferentes y tienen propiedades distintas (incluida la masa).
3 Los átomos de un elemento no se transforman en átomos diferentes durante las reacciones químicas, es decir, los átomos no se crean ni se destruyen en las reacciones químicas.
4 Cuando se combinan átomos de más de un elemento se forman compuestos. Un compuesto dado siempre tiene el mismo número relativo de la misma clase de átomos.
Actualmente, se considera que el átomo está formado fundamentalmente de tres partículas subatómicas, es decir, partículas más pequeñas que el átomo, que afectan al comportamiento químico de los elementos. Estas son protonesy neutronesque se hallan en el núcleo del átomo y electronesque se encuentran orbitando alrededor del núcleo, gracias a la fuerza de atracción producida por la diferencia de carga entre estos y los protones:
1 Protones (p+): son partículas subatómicas que residen en el núcleo del átomo con carga positiva 1+ y una de masa de 1,6725 · 10–27 kg equivalente a 1,0073 uma (unidad de masa atómica).
2 Electrones (e-): son partículas subatómicas que orbitan alrededor del núcleo con carga negativa 1– y una masa de 9,1 · 10–31 kg equivalente a 5,486 · 10–4 uma.
3 Neutrones (n): son partículas subatómicas que residen en el núcleo del átomo junto con los protones y con carga neutra, tal y como su nombre indica, una masa de 1,6748 · 10–27 kg equivalente a 1,0087 uma.
Las masas de los átomos son muy pequeñas, y por tanto dichas cantidades se suelen expresar en una unidad denominada unidad de masa atómica(uma), donde su equivalencia con el gramo es: 1 uma = 1,66054 · 10 –27kg.

Recuerde
Un elemento químico viene caracterizado por el número de partículas que hay de cada tipo. De esta forma, se definen el número atómico y másico.
Número atómico
Se representa por la letra Z e indica el número de protones que hay en el núcleo.
Número másico
Se representa por la letra A e indica el número total de partículas que hay en el núcleo. Es decir, protones más neutrones (N), por tanto:
A = Z + N
Indica la masa aproximada que tiene el átomo en uma.
Número de electrones
En un átomo con carga neutra el número de electrones coincide con el número atómico. Si se trata de un ión, es decir, de un átomo o molécula que no tiene carga neutra, se distingue entre anión(ión con carga negativa), donde el número de electrones es mayor que el de protones (ha ganado tantos electrones como indique la carga negativa) y catión(ión con carga positiva), donde el número de electrones es menor que el de protones (ha perdido tantos electrones como me indique la carga positiva).
Un elemento cualquiera (X) se representa en función de su número atómico, másico y carga de la siguiente forma: .


Aplicación práctica
Un átomo de fósforo con carga neutra se representa indicando su número atómico y másico de la siguiente forma:

Indique el número de partículas subatómicas que tiene de cada tipo.
SOLUCIÓN
El número atómico Z = 15, por tanto el átomo está formado por 15 protones, presentes en el núcleo, y por 15 electrones, dado que su carga es neutra. El número de neutrones (N) se obtiene sabiendo que su número másico es 31, y este indica el número de protones más neutrones presentes en el núcleo. De esta forma:
A = Z + N → N = A – N = 31 – 15 = 16 neutrones.
Isótopos
Dos átomos del mismo elemento, es decir, con números atómicos iguales, que tienen distinto número másico -ya que el número de neutrones presentes en el núcleo es distinto- se denominan isótopos,por ejemplo:
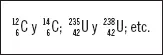
En el intento de explicar la estructura interna de los átomos, algunos científicos, a lo largo de la historia de la química, han planteado sus propios modelos basados en la experiementación y el estudio de los elementos.
Modelo atómico de Rutherford
Tras una serie de experimentaciones con partículas radiactivas (descubiertas y estudiadas anteriomente por Becquerel y el matrimonio Curie) Rutherford distingue dos zonas dentro del átomo: el núcleoy la corteza.El núcleo está formado por partículas denominadas protones y neutrones, las cuales no tienen por qué coincidir en número y que proporcionan al átomo su masa característica.

Recuerde
En la corteza es donde se encuentran los electrones orbitando alrededor del núcleo debido a la fuerza de atracción por diferencia de carga con los protones.
Este modelo atómico presenta una serie de problemas a los cuales no consigue dar respuesta; por ejemplo, según Rutherford, los electrones orbitan alrededor del núcleo, describiendo trayectorias circulares o elípticas, con lo que los electrones estarían sometidos a una fuerza centrípeta o normal, y de esta forma deberían emitir energía en forma de ondas electromagnéticas, lo cual no sucede.
Por otra parte, no tiene en cuenta la posible interacción entre los electrones en la corteza, lo que daría lugar a una repulsión electrónica.
Modelo atómico de Bohr
Los átomos están construidos según el modelo atómico de Rutherford, pero Bohr introduce el concepto de que los electrones solo pueden tener ciertos valores de energía, y, por tanto, no podrán estar a cualquier distancia del núcleo, sino que solo son posibles las órbitas correspondientes a las energías permitidas. Estas órbitas se denominan capasy vienen identificadas por un número, conocido como número cuántico principal “n”(n = 1, 2, 3, 4, etc.). En la naturaleza, los átomos solo tienen electrones hasta la capa 7.
Читать дальше