8. Nomenclatura y formulación química inorgánica
9. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 2 Propiedades físico-químicas de la materia
1. Introducción
2. Clasificación de la materia
3. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 3 Estequiometría de las reacciones químicas
1. Introducción
2. El concepto de mol
3. Pesos atómicos y moleculares
4. Estequiometría de elementos y compuestos
5. Ecuaciones químicas
6. Clasificación de las reacciones químicas
7. Cálculos estequiométricos
8. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 4 Cinética química y equilibrio químico
1. Introducción
2. Cinética química
3. Equilibrio químico
4. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 5 Leyes de los gases
1. Introducción
2. La atmósfera terrestre
3. Presión atmosférica
4. Las leyes de los gases
5. La ecuación de los gases ideales
6. Los gases reales
7. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 6 Disoluciones
1. Introducción
2. Mezclas
3. Tipos de disoluciones
4. Expresiones de la concentración
5. La solubilidad
6. Reacciones de precipitación
7. La ley de Raoult (ley de las presiones parciales)
8. Propiedades coligativas
9. Concepto ácido-base. El pH
10. Hidrólisis
11. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 7 Enlace químico
1. Introducción
2. Estabilidad atómica, regla del octeto y diagrama de Lewis
3. Tipos de enlace
4. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 8 Nomenclatura y formulación química orgánica
1. Introducción
2. Tipos de fórmulas de las moléculas
3. Hidrocarburos
4. Haluros o halogenuros
5. Grupos funcionales con oxígeno
6. Grupos funcionales con nitrógeno
7. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 9 Química del carbono
1. Introducción
2. Fórmulas químicas
3. Cadena carbonada. Clases de átomos de carbono
4. Función química y grupo funcional
5. Isómeros
6. Nomenclatura. Principales grupos funcionales orgánicos
7. Reacciones orgánicas
8. Compuestos hidrocarbonados. Hidrocarburos del petróleo
9. Resumen
Ejercicios de repaso y autoevaluación
Bloque 2 Física aplicada
Capítulo 1 Magnitudes y medida
1. Introducción
2. Unidades de medida. Unidades fundamentales y derivadas
3. Factores de conversión. Unidades. Volumen y Capacidad
4. Estadística y su aplicación en la medida
5. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 2 Cinemática y dinámica
1. Introducción
2. Mecánica. Definiciones
3. Movimiento rectilíneo uniforme y variado. Caída libre
4. Principios de la dinámica. Concepto de fuerza
5. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 3 Trabajo y energía
1. Introducción
2. Energía cinética y potencial. Energía mecánica
3. Trabajo. Concepto. Unidades. Trabajo de una fuerza
4. Energía cinética y trabajo. Teorema de las fuerzas vivas
5. Energía potencial y trabajo. Trabajo de elevación
6. Principio de conservación de la energía mecánica
7. Potencia. Unidades
8. Resumen
Ejercicios de repaso y autoevaluación
Capítulo 4 Presión
1. Introducción
2. Concepto de presión. Fuerza y presión. Unidades
3. Peso y masa. Densidad. Peso específico. Unidades
4. Viscosidad
5. Presión de vapor, presión parcial. Puntos de ebullición y de fusión
6. Otras propiedades específicas de la materia
7. Resumen
Ejercicios de repaso y autoevaluación
Bibliografía
Bloque 1
Química aplicada
Capítulo 1
Elementos y compuestos químicos
A lo largo de la historia de la química se ha trabajado continuamente en el ejercicio de descubrir nuevos elementos químicos. La mayor parte de los elementos presentes en la naturaleza son estables (no lo son, por ejemplo, los elementos radiactivos). Aunque se encuentren en numerosos compuestos, durante muchos años han pasado desapercibidos a los científicos. Es gracias a los avances tecnológicos del siglo XIX cuando se consigue separar dichos elementos de los compuestos de los que forman parte, para así estudiarlos y poder identificarlos.
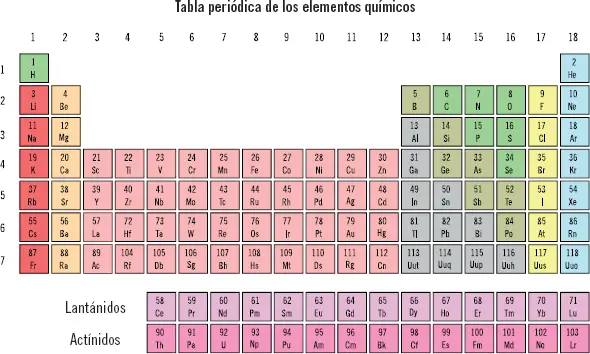
2. Ordenación periódica de los elementos químicos
A medida que se fueron conociendo más elementos químicos, se planteó por parte de los científicos la necesidad de clasificarlos en función de las propiedades que presentaban, tanto físicas -densidad, punto de fusión, punto de ebullición etc.-, como químicas -capacidad de reacción con otros elementos, etc.
En 1869, los científicos Dimitri Mendeleiev (Rusia) y Lothar Meyer (Alemania) realizaron sendas clasificaciones de los elementos muy parecidas entre sí en función de las propiedades que presentaban, aunque fue Mendeleiev quien promovió dichas ideas de una forma más enérgica. Ambos indicaron que dichas propiedades varían periódicamente si los elementos se ordenan de forma creciente según sus pesos atómicos. Mendeleiev dejó huecos en su tabla y predijo que correspondían a elementos aún no descubiertos, aunque calculó qué propiedades debían tener a partir de los elementos adyacentes, constatándose, posteriormente a sus descubrimientos, que presentaban propiedades muy parecidas a las predichas por el científico alemán.
En 1913, con el desarrollo del concepto de número atómico(número de protones presentes en el núcleo, así como números de electrones presentes en la corteza) por parte del físico inglés Henry Moseley, se llega a la tabla periódica actual.

Nota
En dicha tabla, los elementos se ordenan en función creciente de sus números atómicos.
La tabla periódica está formada por 18 columnas verticales, denominadas grupos o familias,donde se recogen elementos que presentan propiedades físicas y químicas parecidas, y 7 filas horizontales, denominadas períodos.
La mayoría de los grupos presentan nombres propios. Así, los elementos del primer grupo se llaman alcalinosy los del segundo alcalinotérreos;los elementos del grupo 13 [columna del boro (B)] reciben el nombre de térreos;los del grupo 14 [columna del carbono (C)] carbonoideos;los del 15 [columna del nitrógeno (N)] nitrogenoideos;los del 16 [columna del oxígeno (O)] anfígenos;los del 17 [columna del flúor (F)] halógenosy los del grupo 18 [columna del helio (He)] gases nobles. El resto de elementos son los correspondientes a los llamados metales de transición.
Las dos filas de elementos que aparecen aisladas de la tabla reciben el nombre de lantánidosy actínidos,donde si se observa el orden de número atómico, la primera de ellas corresponde al período 6 y continuaría después del lantano, mientras que la segunda corresponde al período 7 y seguiría al actinio. Son 28 elementos en total los que se consideran del grupo 3, al presentar propiedades parecidas al lantano y actinio.
3. Teoría atómica de la materia
Читать дальше














