M(H 20) n+L→ М(Н 2О) п–1L + H 20, (1.1)
М – центральный ион, L – лиганд (органический или неорганический ион или нейтральная молекула), заряды для простоты опущены.
В процессе комплексообразования молекулы растворителя, окружающие центральный ион могут последовательно замещаться ионами или молекулами лиганда, что в итоге приводит к образованию комплекса ML n , где n – число лигандов в комплексе. Это число равно координационному числу, если лиганды образуют с центральным ионом только одну связь. Координационное число зависит от природы лиганда, поэтому к приписыванию данному центральному иону одного определенного координационного числа следует относиться с осторожностью. Классический подход к определению структуры координационных соединений заключался в том, чтобы установить структуру неизвестного соединения на основе структур известных изомеров. Структуры плоского квадрата, тетраэдра и октаэдра (рис. 1.2.), приписанные соединениям, были подтверждены физико-химическими методами. Хотя наиболее часто встречаются координационные числа 6 или 4, известны соединения, в которых центральный ион имеет координационное число вплоть до 10 – 12.
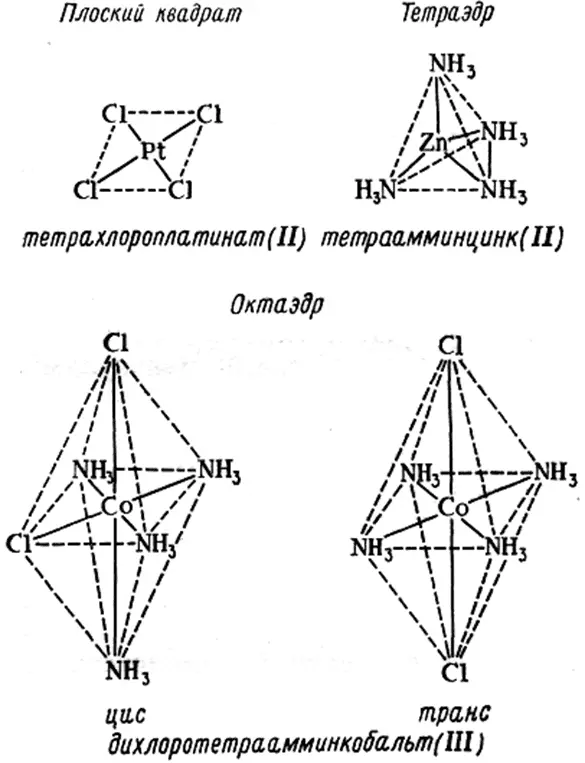
Рис. 1.2. Образование комплексов различной структуры [1] .
Равновесия реакций комплексообразования
В общем случае образование комплексного соединения можно выразить следующим уравнением:
mM + nL↔M mL, (1.2)
тогда термодинамическая константа комплексообразования:
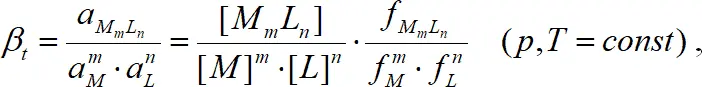 (1.3)
(1.3)
где a M = f[ M ] – активность, f – коэффициент активности, [ ] – символ концентрации. Согласно теории Дебая-Хюккеля, коэффициенты активности в разбавленных растворах в первом приближении определяются только ионной силой раствора и могут быть рассчитаны по уравнению Дэвиса [2].
При постоянной ионной силе J = const концентрационная константа β отличается от термодинамической константы β tпри J = 0 на постоянную величину, поэтому
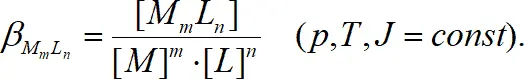 (1.4)
(1.4)
Если в структуре комплекса существует только один центральный атом, то он называется моноядерным, если m ≠ 1, то полиядерным. Хотя полиядерные комплексы встречаются также часто, как и моноядерные, в большинстве случаев их образованием пренебрегают, особенно при низких концентрациях.
Комплексы обычно образуются ступенчато, процесс характеризуется ступенчатыми константами комплексообразования K i:
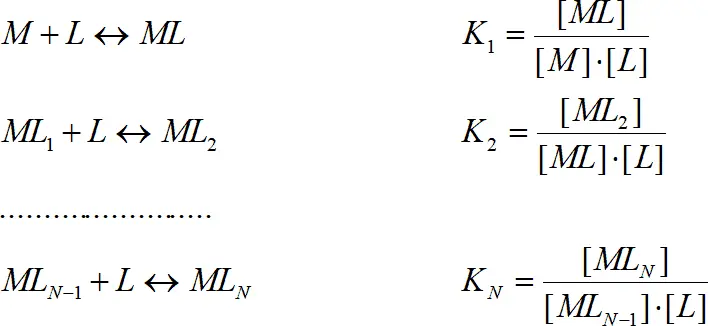 (1.5)
(1.5)
Проведя подстановки:
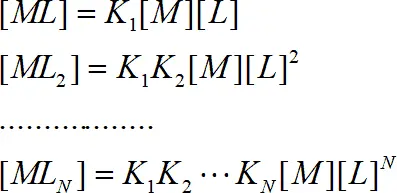
получаем
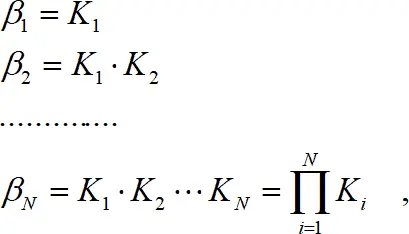 (1.6)
(1.6)
где β N – общая константа образования (устойчивости). В данном выражении N – число присоединенных лигандов, а не координационное число. Если рассматривать обратный процесс, то получаем реакцию диссоциации, которая характеризуется константой диссоциации или нестойкости k :
 (1.7)
(1.7)
Константы нестойкости ступенчатые – обратные величины ступенчатым константам устойчивости. Общая константа нестойкости
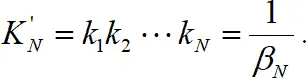 (1.8)
(1.8)
Для определения констант и описания форм состояния ионов в растворе имеют большое значение соотношения между константами и аналитически измеряемыми величинами. Общая концентрация металла в растворе в виде свободного иона и комплексных частиц определяется уравнением:
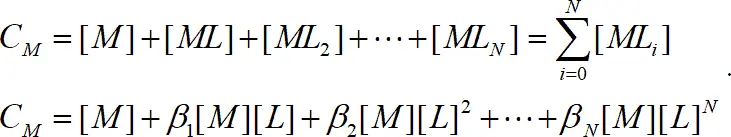 (1.9)
(1.9)
Введя 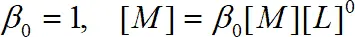 , получаем
, получаем
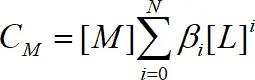 , N – максимальное число лигандов в комплексе.
, N – максимальное число лигандов в комплексе.
Читать дальше


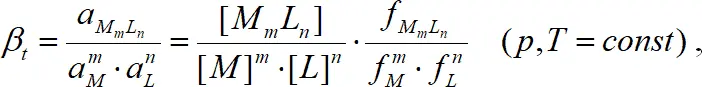 (1.3)
(1.3)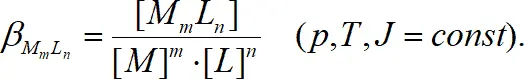 (1.4)
(1.4)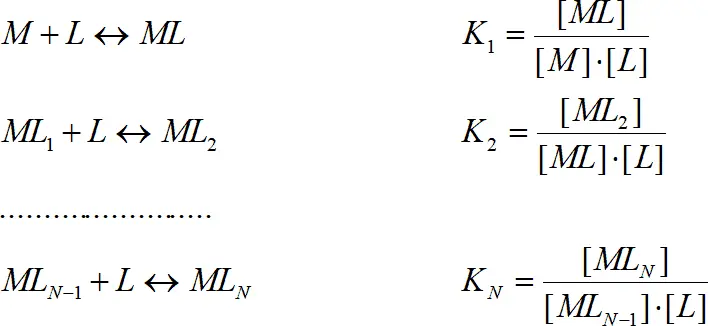 (1.5)
(1.5)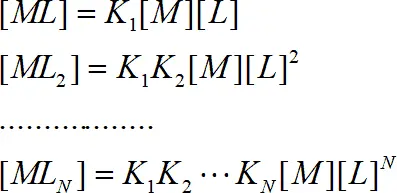
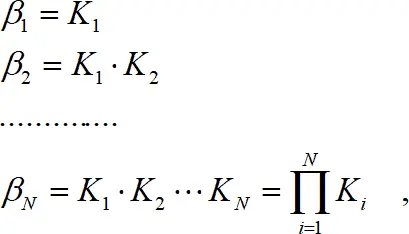 (1.6)
(1.6) (1.7)
(1.7)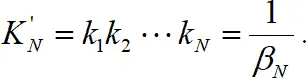 (1.8)
(1.8)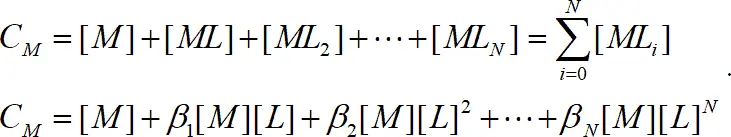 (1.9)
(1.9)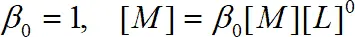 , получаем
, получаем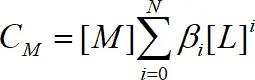 , N – максимальное число лигандов в комплексе.
, N – максимальное число лигандов в комплексе.