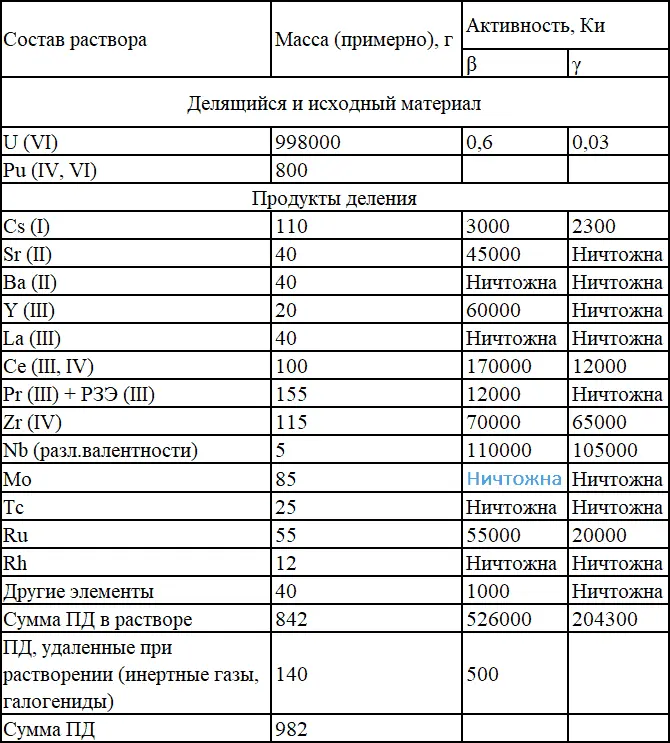
Таблица 1.1.
Состав раствора, полученного при растворении 1000 кг урана с глубиной выгорания до 1000 МВт•сут/т, время выдержки – 100 сут.
Основные научные направления кафедры радиохимии связаны с физико-химией гетерогенных систем, синтезом специфических и селективных неорганических сорбентов с заранее заданными свойствами и теорией межфазного распределения растворенных веществ:
• Изучение закономерностей межфазного переноса радионуклидов из растворов различного происхождения в фазу неорганических сорбентов;
• Исследование состояния радиоактивных микрокомпонентов в водных растворах природного и техногенного происхождения.
Вклад в теорию межфазного распределения радионуклидов-микрокомпонентов сделан в основном трудами Ю. В. Егорова, Н. Д. Бетенекова, В. Д. Пузако, В. В. Кафтайлова, Е. В. Полякова и Т. А. Недобух. Эта задача в настоящее время интересует не только технологов и аналитиков, но и геохимиков, специалистов в области прикладной экологии, токсикологии и др. Приемы концентрирования и разделения веществ, находящихся в разбавленных и сложных по составу растворах, являются основными операциями современных технологий, так как именно эти процессы (концентрирование, выделение и разделение) определяют успешность обезвреживания отходов, переработки многокомпонентного (полиметаллического) сырья, технологии особо чистых веществ и материалов с точно дозированными примесями. Учеными кафедры разработан теоpетический анализ влияния истинно– и псевдоколлоидных фоpм соpбата на закономеpности статики и кинетики сорбции. С использованием методов соpбции, электpофоpеза, ультpафильтpации с пpименением ядеpных фильтpов и ультpацентpифугиpования исследованы фоpмы состояния радиоактивных микpокомпонентов в различных pаствоpах (пpесные воды, моpская вода и хлоpидно-натpиевые гидpотеpмы).
Таким образом, изучение и учет физико-химического поведения микрокомпонентов в сложных системах является не только чисто исследовательской проблемой, но и затрагивает технологические разработки, а для решения экологических задач может стать определяющим.
Состояние микрокомпонентов в водных растворах
Под термином "состояние" в радиохимии подразумевается совокупность всех форм, образованных радионуклидом в водном растворе:
а) простые акваионы – M (H 2O) N z+;
б) ионные пары или внешнесферные комплексы;
в) комплексные ионы, образованные центральным ионом ( М z+ ) и лигандами ( L n- ), причем лиганды могут быть одинаковой или различной химической природы – {M(H 2O) N-iL i} z-ni ;
г) моноядерные продукты гидролиза {M(H 2O) N-i(OH) i} z-i ;
д) полиядерные гидроксокомплексы – {M j(H 2O) j(N-i)(OH) i} jz-i ;
е) гетерополиядерные гидроксокомплексы;
ж) истинные радиоколлоиды;
з) псевдорадиоколлоиды.
Знание форм состояния радионуклидов чрезвычайно важно, так как они определяют поведение радионуклида в любых технологических операциях (сокристаллизация, соосаждение, сорбция, ионный обмен, экстракция, электролиз и т.п.). Поэтому представляют интерес расчетные методы, позволяющие на основании справочных данных получить предварительную оценку концентрации (или доли) каждой из возможных форм состояния радионуклида в растворе конкретного состава.
1.2. Ионо-дисперсное состояние микрокомпонентов в растворах. Комплексные соединения
Комплексные (координационные) соединения. Устойчивость координационных соединений. Внутрикомплексные (хелатные) соединения. Лиганды. Дентатность лиганда. Монодентатные и полидентатные лиганды. Устойчивость внутрикомплексых соединений. Размер хелатного цикла. Хелатный эффект.
К ионно-дисперсным формам относятся простые акваионы, моноядерные, полиядерные и гетрополиядерные комплексы.
Описание ионодисперсных форм обычно осуществляют с позиций образования комплексных соединений.
Комплексные соединения или, другими словами, координационные соединения – это частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому ''комплексообразователем'' (центральным атомом), нейтральных молекул или других ионов, называемых лигандами. Для комплексного соединения характерно то, что он сохраняется как самостоятельная единица даже в растворе, хотя может происходить и частичная диссоциация. Комплекс может быть нейтральной частицей или иметь положительный или отрицательный заряд в зависимости от заряда центрального атома и координированных групп – лигандов. В растворе простые ионы не существуют, они образуют с молекулами растворителя сольватные (для водных растворов – акво-) комплексы. Молекулы растворителя более или менее прочно связаны с ионами, молекулы первой сольватной оболочки расположены вокруг иона в определенном порядке. Количество и расположение молекул растворителя вокруг центрального атома определяется объемом иона, плотностью заряда на нем и пространственными условиями. Следовательно, реакцию образования комплексов в растворе можно рассматривать как реакцию обмена молекул растворителя на молекулы лигандов:
Читать дальше