Таким образом, система газообразного тела обладает еще одним параметром — объемом, который тесно связан с температурой и давлением. Плодотворно изучать свойства газов оказалось возможным лишь после того, как физики пришли к представлению о существовании трех названных параметров и вывели т. н. газовые законы. Эти законы провозглашают взаимосвязь между различными параметрами. Короткий рассказ о земной атмосфере и происходящих в ней явлениях убеждает, сколь разнообразны подобные взаимосвязи и как необходимо их изучение для познания физики газов.
Открытие атмосферного давления в середине XVII в. послужило отправной точкой для начала глубоких, всесторонних исследований свойств газа. Эти исследования были обусловлены также растущими нуждами промышленности, которая нуждалась в химическом производстве, а в дальнейшем начала использовать силу пара в тепловых машинах. Уже в XVII столетии был открыт один из классических газовых законов, вошедший во все учебники физики. Его авторами были англичанин P. Бойль и француз Э. Мариотт, которые почти одновременно и независимо друг от друга пришли к открытию этого закона.
Закон Бойля-Мариотта касается изменяющихся параметров газа постоянной массы, как, впрочем, и все остальные газовые законы. Масса должна быть постоянной, поскольку это означает неизменное количество молекул. Бойль и Мариотт проводили в целом сходные опыты, не имевшие принципиальных отличий. В частности, Бойль использовал изогнутую стеклянную трубку, которую заполнял ртутью через ее открытый конец, тогда как второй был запаян. Изгиб делил трубку на два неравных колена — длинное с открытым концом и короткое с запаянным концом.
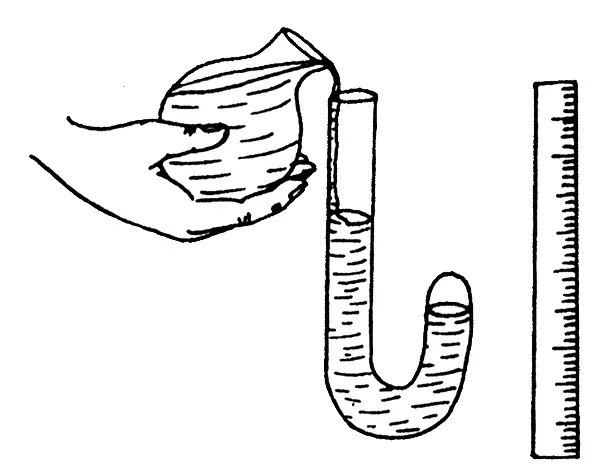
По мере прибавления ртути в длинном колене жидкий металл оказывал все большее давление на воздух, который оказался «запертым» в коротком колене с запаянным концом. Поэтому Бойль имел возможность наблюдать процесс сжатия воздуха по мере возрастания давления. Рассчитать давление было нетрудно, поскольку объем добавленной в трубку ртути был ученому прекрасно известен. Измерения показали, что при неизменной температуре изменение давления обратно пропорционально изменению объема.
Закон Бойля-Мариотта имеет любопытные следствия. Например, этот закон гласит, что скорость истечения газа из емкости не зависит от давления этого газа. Внешнее давление, если оно меняется, будет оказывать влияние на истечение газовой струи, но никак не на собственное. Истечение газа в вакуум полностью подтверждает справедливость этого утверждения. Сжатый газ при любой силе сжатия вытекает с одинаковой скоростью. Причиной тому является взаимосвязь газовых параметров. Так как объем обратно пропорционален давлению, то плотность газа (масса на объем) прямо пропорциональна давлению.
Получается, что стоит сжать газ с большей силой, как пропорционально возрастает плотность и масса вещества истекающей струи. Масса и сила связаны по второму закону Ньютона. Их отношение дает ускорение. Поскольку масса и сила изменяются пропорционально друг другу, ускорение останется неизменным. А значит, и скорость струи газа не увеличится. Другим удивительным следствием газового закона является то, что он зачастую не соблюдается.
Рассмотрим другой пример. На дне океана находится пузырек воздуха. С какой глубины он сможет подняться? Всем прекрасно известно о страшном давлении воды на больших глубинах, способном раздавить корпус подводной лодки. Естественно, пузырек будет сжиматься, и на определенной глубине плотность воздуха сравняется с плотностью воды. Воздух перестанет быть легким, следовательно, пузырек не сможет всплыть.
Поскольку, согласно закону Бойля-Мариотта, плотность газа прямо пропорциональна его давлению, то не будет ошибкой предположить, что при давлении 81 040 кПа (в 800 раз больше атмосферного) воздух сожмется в 800 раз. Его плотность окажется в 1,03 раза выше плотности воды. Поскольку такое давление царит на больших глубинах Мирового океана (свыше 4000 м), то практически нигде здесь воздушный пузырек не может всплыть на поверхность. Однако в таких рассуждениях как раз и содержится ошибка.
Закон Бойля-Мариотта справедлив лишь для небольших давлений. При столь существенном сжатии он уже перестает действовать. Полностью соответствует закону идеальный газ — модель, в которой игнорируются размеры молекул и их взаимное отталкивание. В природе из всех реальных газов подобен идеальному только водород, и то его молекулы не позволяют свободно менять давление и плотность газа. Воздух же отступает от действия закона уже при сжатии до давления 20 260 кПа (в 200 раз больше атмосферного). Его плотность превосходит плотность воздуха при нормальном давлении всего в 190 раз.
Читать дальше













