При гидратации поверхностные метокси-частицы и адсорбированный метанол переходят в свободный метанол. Результаты показывают эволюцию активных центров и образование метоксидов меди и адсорбированного метанола при активации метана на цеолите Cu / Na – ZSM-5. Ожидается, что наше механистическое понимание процесса превращения метана в метанол на цеолите Cu / Na – ZSM-5 может потенциально пролить свет на окисление CH 4в pMMO и рациональный дизайн биомиметических каталитических систем.
Как показано на рисунке 1.6., CH 4слабо адсорбируется с энергией адсорбции -0,14 эВ, а затем реагирует с O, соседним с пятикоординированным Rh, с образованием промежуточного соединения CH 3O* и OH* с относительно низким барьером 0,67 эВ, что указывает на О соседний пятикоординированный Rh обладает относительно высокой активностью по активации CH 4.
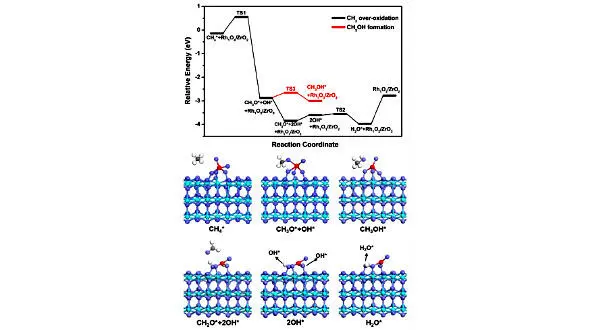
Рис. 1.6. Энергетические профили и структуры активации CH 4 и переокисления CH 3 при пятикоординированном Rh в Rh 1O 4 / ZrO 2 (101): голубые, фиолетовые, красные, серые и белые шары представляют атомы Zr, O, Rh, C и H соответственно [44]
Однако образовавшиеся частицы CH 3O нестабильны и самопроизвольно подвергаются дальнейшему дегидрированию с образованием CH 2O без энергетического барьера. При этом образование CH 3OH по реакции между CH 3O и соседним H имеет энергетический барьер 0,32 эВ.
Эти результаты показывают, что промежуточный CH 3O, образованный при пятикоординированном Rh, не может стабильно существовать, что можно объяснить сильным взаимодействием между частицами CH 3O и соседними с Rh атомами O. Стабильные виды CH 3играют ключевую роль в образовании метанола. Следовательно, пятикоординированная структура Rh не должна быть активным центром образования метанола из-за переокисления частиц СН 3, хотя она имеет относительно низкий энергетический барьер для активации СН 4. Образовавшиеся виды CH 2O слабо связываются с поверхностью. Десорбция CH 2O требует низкой энергии 0,23 эВ, что указывает на то, что десорбция CH 2O довольно проста. Затем через перенос H образуется H 2O, а десорбция H2O приводит к образованию трехкоординированной структуры Rh 1O 2/ ZrO 2.
Впоследствии H 2O 2адсорбируется на границе раздела Rh 1O 2-ZrO 2с энергией адсорбции -0,97 эВ (рис. 1.7). Адсорбированные H 2O 2и Rh-O синергетически активируют CH 4, приводя к образованию частиц CH 3O и H 2O. Расчетный активационный барьер для диссоциации CH 4составляет 1,87 эВ, что выше, чем (1,23 эВ), о котором сообщалось в предыдущем исследовании. Это можно объяснить различными расчетными структурами. В исследовании авторы рассматривали легированную Rh структуру ZrO 2, в которой один поверхностный атом Zr на поверхности ZrO 2(101) замещен атомом Rh. Они обнаружили, что H 2O 2может самопроизвольно диссоциировать на частицы O 2* и 2H* на поверхности ZrO 2(101), легированной Rh, а диссоциированные поверхностные частицы O 2* действуют в качестве активного центра диссоциации CH4 с энергетическим барьером 1,23 эВ. Напротив, в нашем исследовании мы рассчитали модель Rh, поддерживаемую ZrO 2, в которой один атом Rh поддерживается на поверхности ZrO 2(101). Мы обнаружили, что H 2O 2не может спонтанно диссоциировать на O 2* и 2H* на Rh, поддерживаемом ZrO 2. Таким образом, разный активный сайт приводит к разной энергии активации.
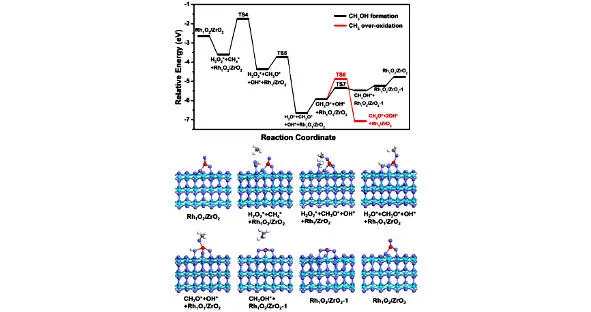
Рис. 1.7. Энергетические профили и структуры образования стабильных видов CH 3. Голубые, фиолетовые, красные, серые и белые шары представляют атомы Zr, O, Rh, C и H соответственно [44]
Затем десорбция H 2O приводит к образованию четырех-координированной структуры Rh-O, и частицы CH 3O почти перпендикулярны поверхности, как показано на рисунке 1.9. Чтобы определить, является ли эта сформированная разновидность CH 3O стабильной или продолжает подвергаться дегидрированию, они рассчитал процесс дегидрирования CH 3O.
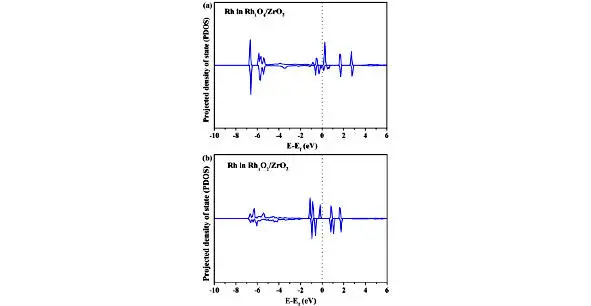
Рис. 1.9. Сравнение плотности состояний (DOS) для Rh в (a) Rh 1O 4 / ZrO 2 (101) и (b) Rh 1O 2 / ZrO 2 (101) [44]
Энергетический барьер этого процесса был рассчитан на уровне 1,06 эВ, что почти в два раза больше, чем для образования CH 3OH, что указывает на то, что дальнейшее дегидрирование частиц CH 3O является неблагоприятным и затрудненным по сравнению с образованием CH 3OH. Это может быть связано с тем, что геометрическая конфигурация частиц CH 3O приводит к большому расстоянию между H в CH 3O и O-соседним Rh. Это говорит о том, что виды CH 3при четырехкоординированном Rh стабильны и, таким образом, могут выступать в качестве предшественника для образования CH 3OH.
Читать дальше