Из метана составляет два типа синтеза: метод в 2 стадии и метод во одну стадию. По методу в 2 стадии сначала неполно окисляется метан и получается синтез-газ (оксид углерода и водород). После получения их синтезируется метанол. Реакция показывает ниже:
CH 4+ H 2O = CO +3H 2CO + H 2= CH 3OH
В настоящее время получение метанола из метана принимается метод в 2 стадии по всему миру.
Промышленно в этом методе паровой риформинг метана на катализаторе Ni/ -Al 2O 3, нагретом до 1173 К, происходит в первичном реакторе. Затем непрореагировавший метан подвергается риформингу с кислородом и паром во вторичном реакторе, образуя смесь CO и H 2в равновесии (рис. 1.1).
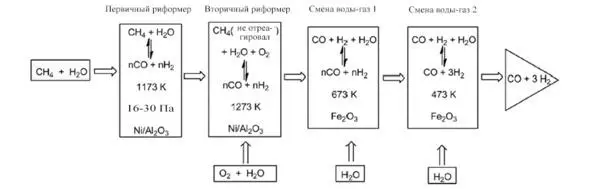
Рис. 1.1. Производство синтез-газа путем традиционного парового риформинга метана [30]
Затем на следующих двух этапах пар добавляется к синтезу-газу, полученному при более мягкой термической обработке, чем раньше (около 673 К), через оксид железа или медные катализаторы. На протяжении этих стадий конверсии водяного газа добавление пара может затем регулировать молярное соотношение H 2: CO до необходимого для дальнейшего использования синтез-газа. В целом синтез-газ стехиометрия направлена на его использование в качестве сырья для синтеза дизельного топлива с помощью процесса Фишера-Тропша (катализатор Fe 2O 3) или синтеза метанола (катализатор Cu – ZnO / Al 2O 3) [31—33]. Хотя это не показано, в этих условиях реакции образуется кокс, что приводит к дезактивации катализатора. Использование никеля, нанесенного на оксиды редкоземельных элементов или щелочных металлов, сводит к минимуму эту нежелательную реакцию и увеличивает срок службы катализатора, ограничивающего углеродные отложения.
В качестве альтернативы метан можно преобразовать с помощью смеси пара и кислорода, нагретой до высокой температуры (около 2273 К) без катализатора. Эти условия способствуют радикальной реакции, обычно называемой «гомогенное окисление» (рис. 1.2).
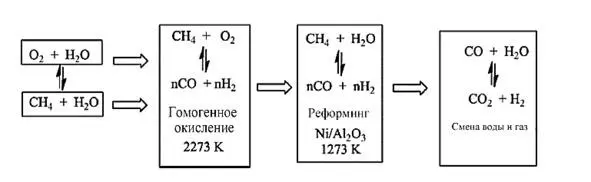
Рис. 1.2. Производство синтез-газа методом автотермического риформинга метана [32]
Следующая стадия происходит в другом реакторе, где полученную смесь затем реформируют на никелевых катализаторах, в результате чего получают синтез-газ и воду, которые можно обрабатывать в условиях реакции конверсии водяного газа. Потом идет основная реакция для получения метанола.
Затем представляем 2 процесса производства метанола из метана.
Процесс BASF (называемый «процесс высокого давления») превращает синтез-газ в метанол на катализаторах ZnO – Cr 2O 3, работающих при высоком давлении (от 250 до 350 бар) и в диапазоне температур от 573 до 673 К, толерантный к сере, яду, присутствующему в больших количествах в сланцевом газе, который широко использовался в начале двадцатого века [34].
Процесс BASF использует жесткие условия реакции для производства метанола. По этой причине несколько исследователей интенсивно работали над достижением более мягких условий реакции. В течение первых тридцати лет прошлого века катализаторы из оксида меди позволили снизить температуру и давление процесса BASF. Однако медные катализаторы обладают высокой чувствительностью к отравлению серой.
Imperial Chemical Industries, Ltd. (ICI) разработала системы очистки синтез-газа. Они обнаружили, что катализатор Cu – ZnO был намного активнее, чем ZnO – Cr 2O 3, хотя первый продолжал легко отравляться серой [35]. Разработка эффективных систем очистки и активных катализаторов привела к тому, что в настоящее время используется процесс, который работает на катализаторе Cu – ZnO / Al 2O 3для преобразования «метгаза» (т.е. синтез-газа с адекватным молярным соотношением между CO и H 2) в метанол под давлением 50 до 100 бар и температур в диапазоне от 513 до 533 К. (рис. 1. 3).
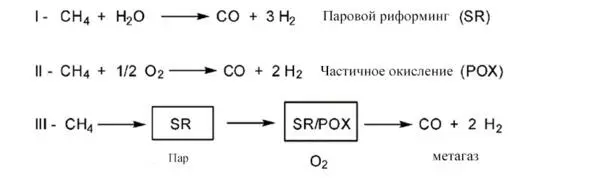
Рис. 1.43 Паровой риформинг метана в сочетании с синтезом метгаза [36]
В данной момент разрывается метод с пользованием катализатором Cu—Zn/Al 2O 3. Этот процесс был первым коммерческим способом производства метанола из синтез-газа при низком давлении.
Первоначально считалось, что активные центры составляют частицы Cu (0). Исследование показало, что другие фазы также играют важную роль в активности и сроке службы катализатора. Действительно, Ноннеман и Понек продемонстрировали, что чистая Cu является неактивным катализатором синтеза метанола. Они пришли к выводу, что ионы Cu (I) образуются на протяжении всего процесса и стабилизируются промоторами (т.e. ZnO, CsCO 3) на поверхности Cu (0), которая поставляется адсорбированными атомами водорода [20, 37—39].
Читать дальше