Обширные исследования были посвящены прямому окислению метана в метанол, которое включает следующие технологии:
– гомогенные процессы без катализатора при высоких температурах, основанные на радикальных реакциях в газовой фазе;
– процессы с твердым катализом в газовой фазе;
– процессы с твердым катализатором в жидкой фазе;
– гомогенно-каталитические процессы в жидкой фазе в присутствии растворимых катализаторов;
– ферментативные каталитические процессы.
Главной проблемой считается в этом процессе сильная сигма связь C— H. Метанол легче окислить до стабильных продуктов чрезмерного окисления (например, CO или CO 2), чем окислить сам метан. Становится трудным контролировать селективность одностадийного процесса окисления метана до метанола.
Обоснование реакции получения метанола
Поскольку атомы в молекуле метана образуют четыре эквивалентных связи CH с четырьмя атомами, образуя симметричную правильную тетраэдрическую структуру, энергия диссоциации связи CH 3-H достигает 435,43 кДж / моль и не приносит пользы другим веществам [40]. Функциональные группы, магнитные свойства, полярность и т. д. стали серьезной проблемой при каталитическом окислении метана до кислородсодержащих соединений. Более того, большинство кислородсодержащих соединений метана не так стабильны, как метан, и легко дополнительно окисляются до диоксида углерода в процессе окисления метана, что делает целевой продукт реакции окисления менее селективным.
Согласно соответствующим результатам термодинамических расчетов, частичное окисление метана до метанола или формальдегида является термодинамически допустимым, например:

Но когда метан и кислород нагреваются до температуры выше 500° C, в продукте остается лишь небольшое количество метанола и формальдегида, которые в основном являются продуктами полного окисления.
В 2019 г. была обнаружена реакция с пероксидом водорода. Реакция в ниже указывают:
CH 4+ H 2O 2= CH 3OH + H 2O
В реакции использовали катализатор FeOOH/m-WO 3、(рис. 1.4.).
Катализатор в этих процессах играют важную роль: во-первых, катализаторы помогают реакцию снижением энергии активации, чтобы ускорила реакция; во-вторых, катализаторы помогают ввести реакции, чтобы получили подходящие продукции.
Для понимания и создания катализаторов требуется знание механизма катализатор во процессе. Так как в последние годы ученые испытали искать как добраться от метана до метанола и достигли своих достижений по-разному.
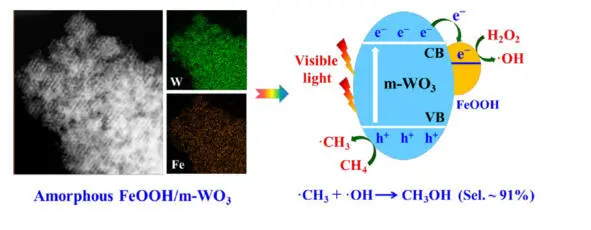
Рис. 1.4. Схема реакции метана с пероксидом водорода [41]
В последних трех годах ученые исследуют катализатор Cu-ZSM-5/цеолит и узнали его механизм действия с молекулами метана. Китайские ученые от Ланьчжоуского университета и института физической химии при КАН обнаружили процесс действия на основе результатов ЭПР и ЯМР [43]. На основании наблюдений ЭПР и ЯМР в твердом состоянии они предложили механизм селективного прямого окисления метана в метанол на цеолите Cu / Na-ZSM-5 (рис. 1.5), который включает три основных этапа:
а) активация метана на [Cu 2O] 2+ядро из цеолита Cu / Na-ZSM-5 и генерирует метанол, а Cu 2+восстанавливается до Cu +;
б) адсорбированный метанол активируется на частицах Cu +, образуя метокси-группы меди (—Cu – O—CH 3) и группу —Al – OH;
в) свободный метанол образуется в результате гидратации метокси-групп меди и вытеснения адсорбированного метанола.
Сообщался о механизме высокоселективного превращения метана в метанол на модифицированном медью цеолите Cu / Na – ZSM-5 при температуре 423 K. Исследование ЭПР показывает, что восстановление ионов Cu 2+до иона Cu +происходило во время превращения. метана в метанол на цеолите Cu / Na – ZSM-5.
Кроме этого, другой доступ обнаружен для получения метанола с помощью катализатора Rh 1/ZrO 2.
Данные спин-улавливания ЭПР in situ демонстрируют, что радикал •CH 3и радикал •OH образуются в процессе метана-метанола на цеолите Cu / Na – ZSM-5. ЯМР-исследование в твердом состоянии подтверждает, что метокси-группы меди и адсорбированный метанол образуются на цеолите Cu / Na-ZSM-5 после активации метана при 423 К.
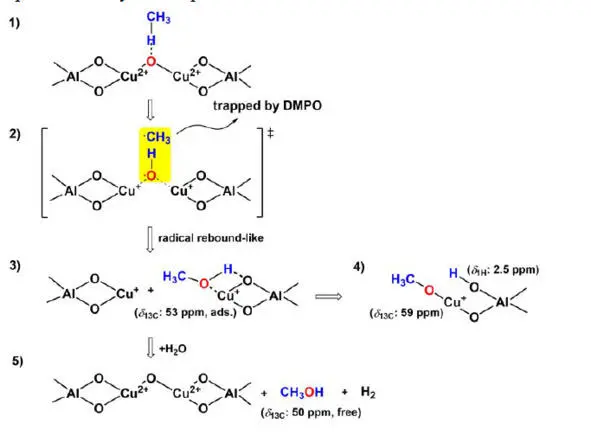
Рис. 1.5. Предложенный механизм превращения метана в метанол на цеолите Cu / Na – ZSM-5 [43]
Читать дальше