Есть три разных вида химических связей, с которыми стоит познакомиться: ионогенная, атомарная и металлическая [36] Всего в химии выделяют шесть типов химической связи. В школьном курсе химии, как правило, изучают четыре типа: ковалентная, ионная, металлическая и водородная. – Прим. науч. ред.
. Во всех этих связях два атома соединяются одним и тем же способом: посредством электронов. Химические соединения возникают путем распределения электронов. Точнее говоря, электронов на внешнем уровне – именно они при химической связи разделяются между атомами, что вы, надеюсь, уже уяснили из главы 2. Причиной, почему атомы вообще соединяются, может быть, например, правило октета. Но какой вид соединения возникнет в результате, зависит от того, как именно распределятся электроны между партнерами по связи.
Ионогенная, или ионная, связьосновывается на том, что один из партнеров дарит электрон другому. Это могут быть несколько электронов, в зависимости от потребностей атомов, связанных, например, с правилом октета. Мы уже видели это на примере фторида натрия (который в зубной пасте) и хлорида натрия (поваренной соли). Возникают положительные и отрицательные заряды, взаимно притягивающиеся катионы и анионы (вспомним главу 2 ). То же самое зачастую происходит и в отношениях – я имею в виду в связях, которые заключают между собой люди. Ведь, как говорится, противоположности притягиваются – вуаля, вот вам и ионная связь!
Однако, в отличие от Штефов, ионное соединение типа хлорида натрия никак нельзя представить себе как просто парочку хлорид плюс натрий. Между положительным натрием и отрицательным хлоридом есть электростатическое притяжение, исходящее от каждого иона радиально по всем направлениям. Каждый ион натрия трехмерно окружает себя хлорид-ионами, и наоборот. В результате получается упорядоченная трехмерная структура – ионная кристаллическая решетка. Ионная кристаллическая решеткаповаренной соли выглядит так.
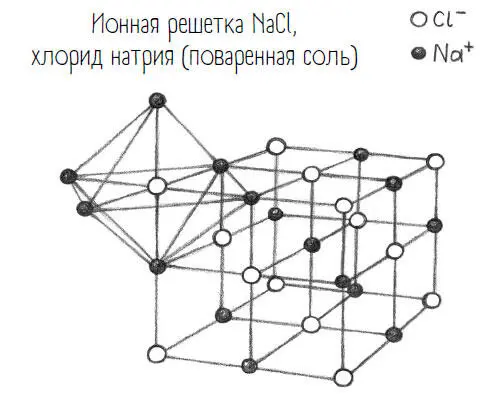
Взглянув теперь на это соединение, его, пожалуй, сложно назвать идеальным браком, как я это сделала в главе 2 . Ионная связь – это вовсе не гармоничные отношения, ведь в ней один отдает, а другой принимает. Но оба счастливы. Как Штефы. Потому что один ничего иного не хочет, кроме как давать, а другой желает только брать. (Очень похоже на окислительно-восстановительные реакции из главы 6 .) Возможно, это все же крепкий брак, хоть и не образцово-показательный, поскольку внешний наблюдатель вполне может осуждать Штеффи и сочувствовать Штефану. Этот принцип химической связи можно заметить в другом типе отношений между людьми: мне кажется, что между Кристиной-мамой и Торбеном-динозавриком отношения очень похожи на ионные.
А теперь посмотрим на другой вид связи, пожалуй, он подходит к нам с Кристиной. В главе 2 такой связью было, например, соединение между углеродом и фтором в тефлоне. Органические соединения, то есть содержащие углерод, априори атомарны, их еще называют ковалентными. Лично мне определение «ковалентное» нравится больше, поскольку «атомарное соединение» мало о чем говорит. Разве не все соединения суть связи между атомами?
Ковалентные партнеры по связи делят между собой электроны, а не то чтобы один давал, а другой принимал. Вместе их удерживают общие электроны, а не электростатическое притяжение между зарядами.
В этой книге вы видели несколько примеров таких ковалентных связей.
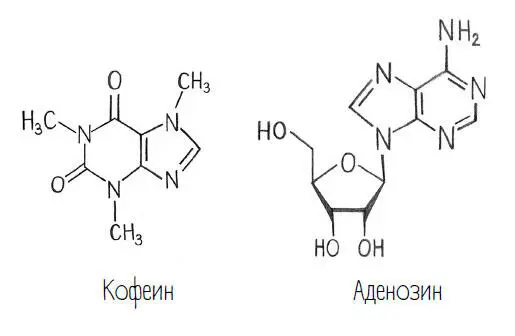
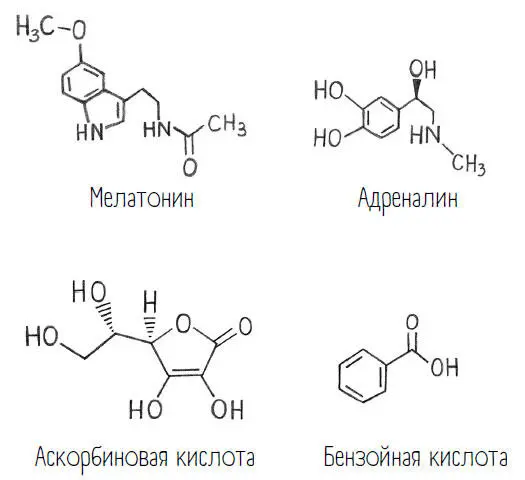
Каждая черточка на этих схемах соответствует ковалентной связи. И, кстати, каждый угол, кроме специально обозначенных, – это атом углерода. Ведь углерод в нашей жизни доминирует, и большинство молекул содержит так много атомов углерода, что можно обойтись без того, чтобы на каждом углу ставить букву «С» (или СН, СН 2, СН 3):
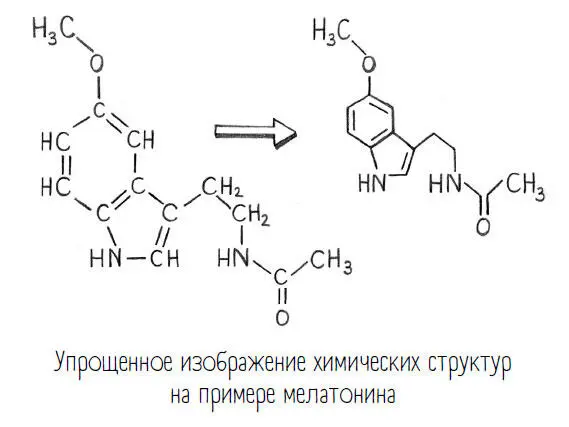
Кстати, причина, по которой углерод – такой мастер на ковалентные связи, еще и в том, что жизнь базируется на углероде и, следовательно, на нашем предположении, что он должен лежать в основе любой жизни. Дело в том, что в противоположность ионной ковалентная связь не происходит радиально по всем направлениям, а имеет определенные направление и угол между двумя связками. Поэтому ковалентные связи выстраивают намного более замысловатые структуры, чем ионные, – как, например, наши ДНК или те же молекулы, которые вы видите в этой книге. Но и простые, маленькие молекулы, как молекулы газа, строятся только ковалентными связями, в то время как ионные связи дают сразу огромные решетчатые структуры.
Читать дальше
Конец ознакомительного отрывка
Купить книгу
![Нгуэн-Ким Май Тхи Комично, как все химично! [Почему не стоит бояться фтора в зубной пасте, тефлона на сковороде, и думать о том, что телефон на зарядке взорвется] обложка книги](/books/390089/nguen-cover.webp)















