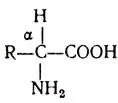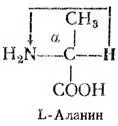Это свойство белков используется в клинике. При отравлении тяжелыми металлами больному вводят per os молоко или сырые яйца с тем, чтобы металлы, денатурируя белки яйца или молока, адсорбировались на их поверхности, не действовали на белки кишечника и желудка и не всасывались в кровь.
В настоящее время установлено, что при кратковременном действии денатурирующего агента денатурированные белки могут перейти обратно в нативное состояние. Этот процесс называется ренатурацией.
Химическое строение белков
Знание свойств белков и их элементарного состава не дает еще представления об их химической структуре.
Для ее изучения используют различные методы, в том числе гидролиз . Он представляет собой процесс расщепления белков на составные части при участии воды и нагревании. Гидролиз может быть 3 видов:
• кислотный,
• щелочной,
• ферментативный.
Для кислотного гидролиза применяются концентрированные растворы соляной и серной кислот и нагревание в течение 24 часов при температуре 100-110°. Щелочной гидролиз протекает при тех же условиях в присутствии 2N растворов щелочей. Ферментативный гидролиз обеспечивает расщепление белков при действии протеолитических ферментов при температуре 37-38°.
Однако ни один из этих видов гидролиза не лишен недостатков. При кислотном и щелочном гидролизах частично разрушаются некоторые составные части белка, а при ферментативном происходит засорение гидролизата продуктами распада самих ферментов. Поэтому, используя данные только всех видов гидролиза, можно получить полное представление о составе белков.
Конечными продуктами гидролиза белков являются аминокислоты. В результате длительных исследований было установлено, что в состав природных белков входит 20 аминокислот в различных сочетаниях. В настоящее время синтезировано около 80 новых аминокислот, которые не встречаются в составе белков организма.
Аминокислоты представляют собой органические кислоты, у которых водород α-углеродного атома замещен аминогруппой — NH 2, т. е. это αаминокислоты.
Общая формула аминокислот следующая:
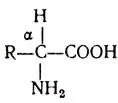
Если у α-углеродного атома все валентности замещены различными функциональными группами (R-радикал не повторяет имеющиеся группы), то такой С-атом называют асимметрическим, а аминокислоту — оптически активной. Она способна вращать плоскость поляризованного луча и иметь стереоизомеры.
Например, в природе существуют 2 стереоизомера аланина.
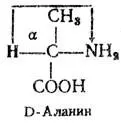
Они различаются расположением аминогруппы у α-углеродного атома. D-Аланин характеризуется тем, что мысленное направление вращения от водорода к аминогруппе через метильную группу идет по часовой стрелке; у его изомера L-аланина это направление противоположное. Вещества, содержащие два стереоизомера, называются рацематами и обозначаются как D, L-вещества. Все природные аминокислоты относятся к L-ряду.
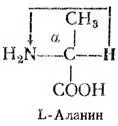
Все аминокислоты являются амфотерными электролитами и в растворе находятся в ионизированном состоянии за счет диссоциации карбоксильных и аминных групп.
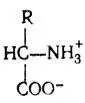
Аминокислоты являются электрически нейтральными. Однако в кислой среде (при подавлении диссоциации карбоксильной группы) они становятся катионами , а в щелочной среде — анионами .
Классификация аминокислот
Все аминокислоты по структуре подразделяются на ациклические и циклические.
Ациклические аминокислоты по количеству аминных или карбоксильных групп делятся на:
1. моноаминомонокарбоновые аминокислоты, имеющие в своем составе одну аминную и одну карбоксильную группу; в водном растворе они нейтральны;
2. моноаминодикарбоновые аминокислоты, имеющие в своем составе одну аминную группу и две карбоксильные; их водный раствор имеет кислую реакцию;
3. диаминомонокарбоновые аминокислоты, в которых на одну карбоксильную группу приходятся две аминные; и; реакция в растворе щелочная.
Читать дальше