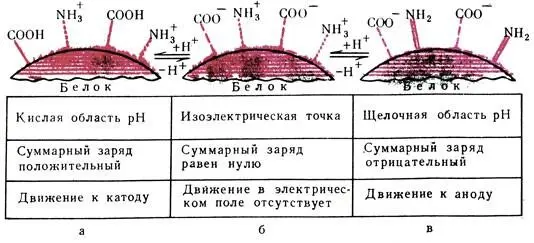
Рис. 10. Белки — амфотерные соединения. а — в кислом растворе суммарный заряд белка положительный и белок становится катионом; б — изоэлектрическая точка белка; суммарный заряд белковой молекулы равен нулю; в — в щелочной среде подавлена диссоциация аминных групп. Заряд белковой молекулы становится отрицательным и белок передвигается к аноду (белок играет роль аниона)
В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н +из NH + 3:
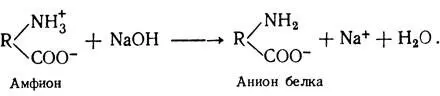
В кислых растворах, наоборот, белок играет роль катиона, как в случае с соляной кислотой:
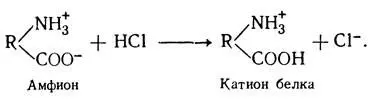
Таким образом, фактором, определяющим поведение белка как аниона или катиона, является концентрация водородных ионов, или значение рН среды. При повышении концентрации водородных ионов (среда кислая — рН 0-7) белок становится катионом, при ее понижении (среда щелочная- рН 7 -14), наоборот, белковые частицы становятся анионами. Такая способность белка проявлять или кислотные, или щелочные свойства характеризует его как амфотерное соединение.
Однако при определенных значениях рН число положительных зарядов белка будет равно числу отрицательных и заряд молекулы в целом будет практически равен нулю. Белковая молекула не будет перемещаться в электрическом поле. При этих условиях белок находится в изоэлектрическом состоянии; рН раствора, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой.Изоэлектрическая точка большинства природных белков лежит в слабокислой среде (рН 4,8-5,4). Молекула таких белков содержит больше карбоксильных групп, чем аминных. Это свидетельствует о том, что в их составе содержится больше дикарбоновых аминокислот (см. Аминокислоты ). В изоэлектрической точке белок находится в наименее устойчивом состоянии и при незначительных изменениях рН среды в кислую или щелочную сторону он легко выпадает в осадок.
Амфотерность белков лежит в основе белковой буферной системы, которая участвует в поддержании определенной реакции среды крови. Амфотерные свойства белков используются для разделения их на отдельные фракции (метод электрофореза) с целью диагностики различных заболеваний и контроля за состоянием больного.
Белки — гидрофильные соединения
Все белки обладают гидрофильными свойствами, т. е. имеют большое сродство с водой. Стабильность белковой молекулы в растворе обусловлена наличием определенного заряда и гидратной (водной) оболочки. В случае удаления этих двух факторов устойчивости белок выпадает в осадок. Выпадение белка в осадок может быть обратимым и необратимым. Обратимое осаждение белков (высаливание) возможно при действии концентрированных растворов солей щелочных или щелочно-земельных металлов, например (NH 4) 2SО 4, NaCl. Удаление этих веществ способствует переводу белков вновь в нативное (природное) состояние. Высаливание белков, таким образом, является обратимым процессом. В зависимости от концентрации соли в осадок будут переходить различные фракции белков. Так, глобулины крови осаждаются при полунасыщении растворов солями, а альбумины — при полном насыщении. Эта способность белков нашла широкое промышленное применение при получении различных фракций белков, например γ-глобулинов.
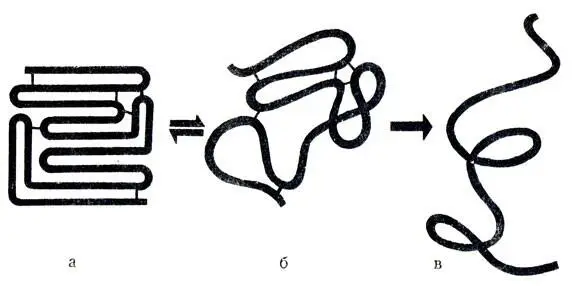
Рис. 11. Схема денатурации. а — нативная молекула; б — развертывание; в — случайный клубок
При необратимых реакциях осаждения белки претерпевают глубокие изменения и неспособны к обратному растворению. Это наблюдается при действии на белок солей тяжелых металлов, сильных кислот и щелочей и т. д. При нагревании до 100° белок выпадает в осадок, при этом в нем происходят необратимые внутримолекулярные превращения, связанные с изменением многочисленных свойств белка, в том числе биологических. Белок, потерявший свои нативные свойства, называется денатурированным , а сам процесс — денатурацией . Схема этого процесса представлена на рис. 11.
Читать дальше















