Köhler G., Milstein С. Continuous cultures of fused cells producing antibody of pre-defined specificity // Nature. – 1975. – Vol. 256, № 5517. – P. 495–497.
Глава 2.
ПЕРВИЧНЫЕ АНТИТЕЛА
2.1. Антитела – компоненты сыворотки крови
Антитела – это растворимые гликопротеины глобулиновой фракции сыворотки крови и других биологических жидкостей, образующиеся в ответ на введение или проникновение антигена (чужеродных веществ, в том числе бактерий, вирусов, токсинов) в организм теплокровных животных (Ройт А. [и др.], 2000). На сегодняшний день антитела являются наиболее важными реагентами для использования в фундаментальных и прикладных исследованиях, что обусловлено их способностью к высокоспецифическому связыванию с антигеном, вызвавшим их образование.
Применяя определенные методические приемы, можно добиться образования антител к практически неограниченному набору антигенов. Однако стоит отметить, что стоимость коммерческих антител и затраты на их получение в условиях лаборатории могут различаться в десятки раз в зависимости от требуемой чистоты, специфичности и области применения, поэтому еще на этапе планирования исследования стоит уделить особое внимание правильному подбору антител. В этом может помочь и данное руководство.
Классические антитела представляют собой крупные мультимерные белки. Основная четырехцепочечная структурная единица иммуноглобулинов образована полипептидными цепями двух разных типов. Меньшие по размеру цепи (легкие L-цепи) имеют молекулярную массу около 25 кДа и состоят из вариабельного VL- и константного СL-доменов. Более крупные (тяжелые H-цепи) имеют молекулярную массу 50 – 80 кДа, состоят из вариабельного VH-, трех константных СН1-, СН2-, СН3-доменов и шарнирного участка (hinge region). Полипептидные цепи удерживаются вместе ковалентными (дисульфидными) и нековалентными связями (Ройт А. [и др.], 2000). Схематически «типичная» структура антитела представлена на рис. 1.
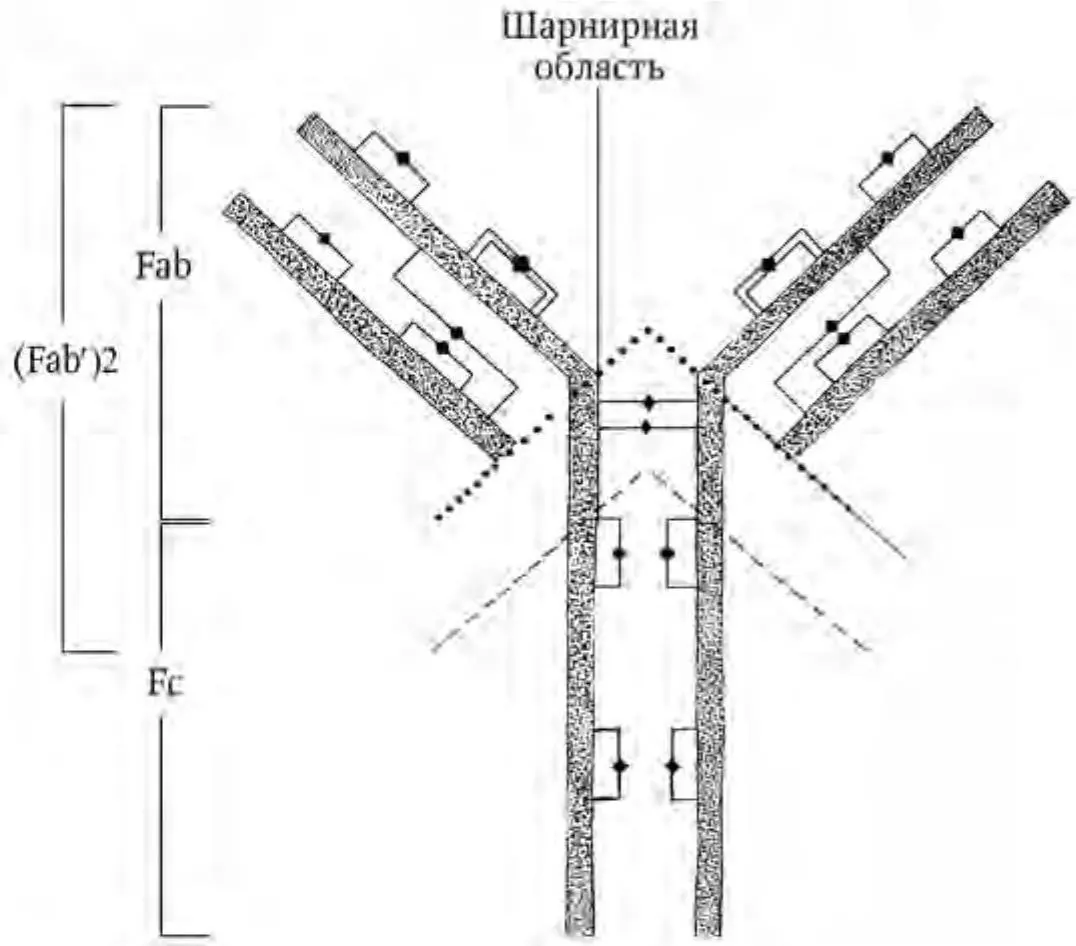
Рис. 1 . Структура кроличьего иммуноглобулина IgG. Тяжелые и легкие цепи образуют вариабельный и константный домены, которые соединены дисульфидными мостиками (♦). При помощи папаина (цистеиновой эндопротеазы) протеолиз разделяет молекулу, в результате чего образуются два антигенсвязывающих фрагмента (Fab) и один кристаллизующийся фрагмент (Fc). Под действием пепсина (аспартатной кислой эндопептидазы) происходит отщепление двухвалентного антигенсвязывающего фрагмента (Fab′)2 (по: Boenisch T., 2001; с изменениями)
В зависимости от размера, заряда, аминокислотной последовательности и содержания углеводов в составе тяжелой цепи различают пять изотипов (классов) антител: IgM, IgG, IgA, IgE и IgD. Класс IgG подразделяется на четыре подкласса (IgG1, IgG2, IgG3, IgG4), которые различаются по антигенной структуре и спектру биологических функций (Burton D. R. [et al.], 1996). IgG – это наиболее широко представленный класс иммуноглобулинов, на его долю приходится 70 – 75 % их общего количества. Класс IgA разделяют на два подкласса (IgA1, IgA2). Все классы и подклассы составляют девять изотипов, которые присутствуют в норме у всех теплокровных. Кроме того, IgM является пентамером, т. е. пять молекул соединяются между собой, а IgA – димером.
При помощи папаина антитела можно расщепить на два одинаковых антигенсвязывающих Fab-фрагмента (fragment antigen binding) и Fc-фрагмент (fragment cristalizable), способный к кристаллизации. Область Fab образована гипервариабельными участками Ни L-цепей и определяет антигенную специфичность; Fc-фрагмент осуществляет эффекторные функции (связывание иммуноглобулина с клетками, компонентами комплемента) (Atassi M. Z., 1984). К Fc-фрагменту антител можно присоединять различные вещества, что используется при постановке иммунохимических реакций.
В 1993 г. группой бельгийских ученых было сделано важное открытие: кроме классических антител в крови некоторых животных (верблюдов, лам и др.) обнаруживаются особые, неканонические антитела с упрощенной структурой. Они состоят из димера укороченной (без CH1-домена) тяжелой цепи; легкая цепь отсутствует, т. е. антигенузнающий участок формируется лишь вариабельными доменами тяжелых цепей. Такие антитела принято называть однодоменными антителами, или мини-антителами. Благодаря малым размерам (молекулярная масса однодоменных антител составляет примерно 12 – 15 кДа) и компактности антигенсвязывающего участка, можно получить мини-антитела, способные узнавать участки антигенов, недоступные для классических антител, в этом состоят весомые преимущества мини-антител (Тиллиб С. В., 2011).
Читать дальше
Конец ознакомительного отрывка
Купить книгу