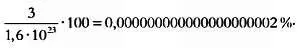Такая теория была разработана австрийским физиком Людвигом Больцманом в конце XIX века, когда он доказал, что макроскопические характеристики газа можно вывести исходя из распределения скоростей его молекул. То есть достаточно знать процент молекул газа с каждой возможной скоростью, чтобы предсказать его поведение. Работа Больцмана была направлена на то, чтобы найти это распределение скоростей для газа в состоянии равновесия, то есть газов, макроскопические свойства которых ощутимым образом не изменяются. Ученый открыл, что скорости молекул в газе распределяются следующим образом.
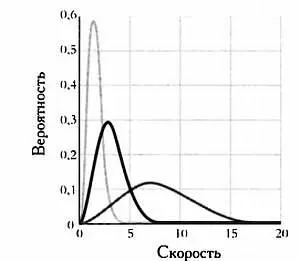
Газ с большим пиком слева соответствует большим температурам.
Чтобы сделать это, ему пришлось воспользоваться несколькими математическими теориями. Одни из них, такие как механика Гамильтона, были хорошо приняты в физическом сообществе, но другие, такие как вероятность и статистика, были совершенно новыми. Ниже мы опишем путь, который привел Больцмана к его закону и математическому обоснованию предыдущего графика.
Давление, объем и температура
Вспомним, что состояние системы в определенный момент времени может быть выражено лишь одной точкой в фазовом пространстве. Эта точка находится в пространстве из 6 N измерений, где 3 N используются для уточнения положения каждой из N частиц, а другие 3 N — для импульсов. Если позволить системе развиваться, точка будет двигаться по фазовому пространству, описывая некоторую траекторию.
В случае с газом в самом начале мы сталкиваемся с проблемой: мы не знаем, в какой точке фазового пространства он находится. Мы знаем только его давление, объем и температуру, но не положение и не импульс его частиц. Часто мы даже не можем быть уверены в том, сколько их. Как же получить какой-либо прогноз поведения системы, о которой мы знаем так мало?
Для начала оценим наше незнание количественно: возьмем бутылку, наполненную кислородом. Если вместимость бутылки — один литр, то в ней содержится приблизительно 2,6·10 22молекул, что означает, что для того, чтобы полностью описать их состояние, нам потребуется это количество чисел, умноженное на шесть, то есть 1,6·10 23(2,6·10 22·6 ~= 1,6·10 23). Предположим, что мы знаем температуру, объем и давление газа, то есть у нас есть три характеристики. Таким образом процент информации, которой мы владеем, в сравнении с информацией, теоретически нам необходимой, равен:
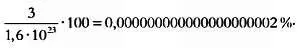
Неужели с этим смехотворным количеством информации мы можем прогнозировать состояние содержимого бутылки в каждый последующий момент? Хотя это и кажется невероятным, но это так.
Чтобы понять, каким образом мы это делаем, рассмотрим, какую информацию о внутреннем состоянии газа дают нам его давление, объем и температура.
Объем указывает нам, в какой области пространства находятся наши молекулы: нет ни одной молекулы кислорода вне бутылки, что помогает нам ограничить точки фазового пространства, в которых может находиться наш газ. Мы знаем, что возможные положения ограничены объемом сосуда. Понять роль, которую играет давление, несколько сложнее. Давление газа — это сила, которую он оказывает на сосуд, содержащий его, на единицу площади.
Представим себе, что газ — это джинн, заточенный в лампе. Чем меньше лампа и чем больше джинн борется за освобождение, тем большее давление он применяет. Чем больше давление, тем сложнее сдерживать газ; и если оно превысит определенные показатели, сосуд лопнет.
Но как связано давление с частицами, образующими газ? Если это вещество образовано огромным числом молекул, которые движутся хаотично, как объяснить эту силу, воздействующую на стенки сосуда? Давление — это результат совокупного действия миллионов молекул газа. Каждая молекула движется приблизительно по прямой до столкновения со стенкой; накопление этих столкновений и вызывает давление. Каждое столкновение воздействует на сосуд с определенной силой, и хотя удар одной молекулы не дает ощутимого эффекта, сотни миллионов молекул способны создать значительную силу.
Чем быстрее движутся молекулы, тем выше давление на стенки сосуда — по той же причине, что удар мячом по лицу тем болезненнее, чем быстрее летит мяч. Кроме того, чем больше молекул, тем большее давление они оказывают, поскольку в этом случае число ударов о стенки сосуда больше. Итак, давление дает нам информацию о движении частиц и об их числе, но в неполной форме: например, две частицы, сталкивающиеся со стенкой на одной и той же скорости, оказывают на нее такую же силу, как и две частицы на разных скоростях, если их средняя скорость равна скорости двух предыдущих частиц. Давление дает нам информацию о средней скорости частиц газа, но ничего не говорит о скорости каждой конкретной частицы.
Читать дальше