Характерным примером связи типа «затычка и дыра» служит связь в молекуле воды Н 2O, состоящей из одного атома кислорода и двух атомов водорода. Атом кислорода имеет 8 электронов. Но оказывается, что 10 электронов, обращающихся вокруг ядра, образуют очень компактную и округлую совокупность. Элемент неон, имеющий 10 электронов, химически очень неактивен и не образует никаких молекул, но в атоме кислорода до этой компактной конфигурации не хватает двух электронов. Поэтому ансамбль из 8 электронов можно описать как компактную округлую конфигурацию с двумя дырками в ней. Форма дырки определена, она отвечает конфигурации недостающего электрона. В случае кислорода дырки простираются от поверхности конфигурации до ее центра и расположены под прямым углом одна к другой (рис. 29, а).
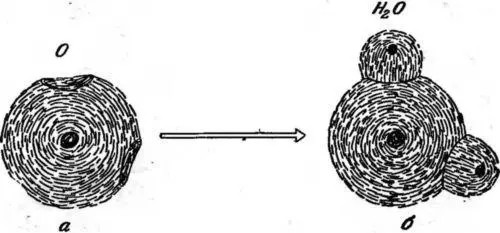
Рис. 29. Атом кислорода (а) и молекула воды (б). электронная конфигурация кислорода имеет две дырки, простирающиеся от ее поверхности до ядра и расположенные под прямым углом. В молекуле воды дырки в кислородном атоме «затыкаются» электронами водорода. Ядра водорода заключены внутри электронных конфигураций водорода (маленькие черные кружки — ядра водорода, большой черный кружок — ядро кислорода).
Теперь мы можем понять строение молекулы воды. Электроны водородных атомов попадают в эти две дырки, атомы водорода служат затычками. Поэтому линии, соединяющие центр атома кислорода с водородными атомами, должны были бы составлять угол 90°. Положительные заряды протонов водородных атомов слегка отталкивают друг друга, что увеличивает этот угол до 108° (рис. 29, б). Это типичная связь типа «затычка и дыра».
Другим интересным примером атома, образующего молекулы, служит атом азота. Он имеет 7 электронов, из которых 4 составляют компактную сферическую конфигурацию вокруг ядра; остальные 3 электрона образуют конфигурации с тремя выступами в трех взаимно перпендикулярных направлениях, например: вверх, вперед и вбок (рис. 30, а).
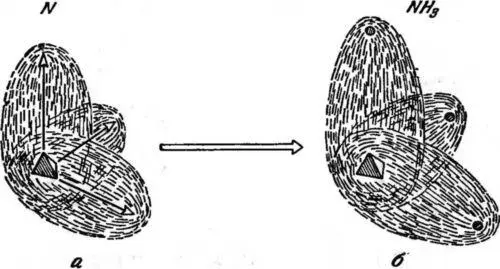
Рис. 30. Атом азота (а) и молекула аммиака (б). В атоме азота мы имеем три электронных выступа, направленных вдоль стрелок под прямыми углами друг к другу. В молекуле аммиака каждый электронный выступ азота сливается с электроном водорода и образует связь типа «электронные близнецы». Густо заштрихованный треугольник — ядро азота; маленькие черные кружки — ядра водорода.
Эта картина позволяет легко понять строение важной молекулы аммиака NH 3, в которой три водородных атома дают три связи типа «электронных близнецов», по одной с каждым выступом. Электроны водородных атомов сливаются с электронами выступов, и получается структура, изображенная на рис. 30, б, где ядра водорода сидят на кончиках выступов азота.
Атом углерода особенно приспособлен к образованию молекул. Он имеет шесть электронов, расположенных следующим образом: два электрона находятся близко от ядра и образуют маленькую округлую конфигурацию, остальные четыре могут располагаться симметричным образом, причем каждый дает радиальный выступ, направленный от центра; концы этих выступов расположены по углам правильного тетраэдра (рис. 31, а).
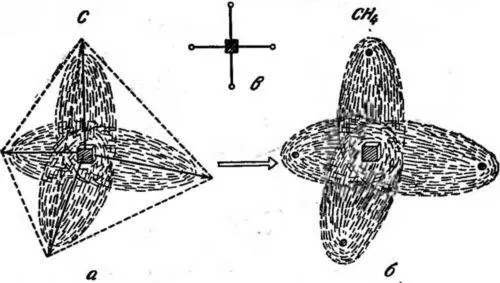
Рис. 31. Атом углерода с четырьмя электронными выступами, направленными по углам правильного тетраэдра (а), молекула метана СН 4(б) и ее схематическое представление (в). Каждый электронный выступ углеродного атома сливается с электроном водорода и образует связь типа «электронные близнецы». Темный квадрат — ядро углерода, маленькие кружки — ядра водорода. Направления связей «близнецы» показаны на (в) отрезками прямых.
Полученная картина позволяет нам понять расположение атомов в молекуле метана СН 4, состоящей из одного атома углерода и четырех атомов водорода. Метан является главной составляющей светильного газа. Электроны водородных атомов сливаются с четырьмя выступами в связи типа «близнецы», образуя структуру с ядром углерода в центре и четырьмя протонами по углам тетраэдра (рис. 31, б).
Другая важная молекула, в которую входит углерод, — это двуокись углерода, состоящая из одного атома углерода и двух атомов кислорода. Здесь все четыре выступа слегка изогнуты; два входят в качестве «затычек» в один атом кислорода, остальные два — в другой. В результате получается вытянутая структура из одного углеродного атома и двух кислородных по бокам (рис. 32).
Читать дальше
![Виктор Вайскопф Наука и удивительное [Как человек понимает природу] обложка книги](/books/32753/viktor-vajskopf-nauka-i-udivitelnoe-kak-chelovek-cover.webp)













