В предыдущей главе мы рассмотрели строение атомов и показали, что волновая природа электронов наделяет атомы их типичными свойствами. Мы смотрели на каждый атом как на отдельную единицу, но не изучали вопроса о том, что происходит при сближении двух атомов. Однако мы знаем, что наименьшими единицами многих веществ служат не атомы, а молекулы, т. е. группы атомов, тесно связанных друг с другом. Если мы хотим понять строение материи, то нам надо узнать не только строение атома, но и причину соединения атомов в молекулы. Мы должны понять природу того, что называется химической связью, которая держит вместе атомы в молекуле, и познакомиться с некоторыми типичными молекулами и их свойствами.
До создания квантовой механики ученые полагали, что существует особая «химическая сила», ответственная за химическую связь. Эта сила должна была обладать совершенно особыми свойствами, так как некоторые атомы соединяются друг с другом очень хорошо, а другие совсем не соединяются. Например, если два атома водорода и один атом кислорода соединились, образовав одно целое, молекулу воды, то к ней уже нельзя присоединить добавочный атом. Молекула насыщена; химические силы как бы исчезли и не могут больше действовать на другие атомы.
Квантовая механика дала полное объяснение химическим явлениям. Здесь не действует никакая новая сила. Химическая связь между атомами возникает в результате взаимодействия электронных конфигураций различных атомов. Химическая связь возникает тогда, когда эти конфигурации хорошо подходят друг другу, как зубцы шестерни или куски разрезанной картины в головоломке. Конфигурации смешиваются и переплетаются, когда атомы приведены в соприкосновение, и в результате появляются новые конфигурации.
Одни атомные конфигурации очень хорошо подходят друг другу, другие — не так хорошо. Химическая связь очень сильно зависит от рода соединяющихся атомов. Иногда атомы подходят друг к другу так хорошо, что при их сближении возникает одна крупная округлая единица, напоминающая первую картину на рис. 28, но только несколько большая и более компактная.
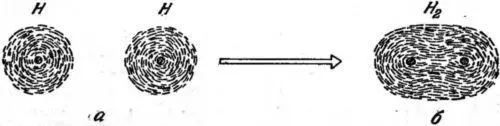
Рис. 28. Два атома водорода, каждый с простейшей электронной конфигурацией (см. фото V), образует молекулу водорода, в которой обе электронные конфигурации сливаются в одну эллиптическую. Точки в центре — ядра водорода.
В этих случаях образуется насыщенная молекула, не присоединяющая других атомов. Насыщенная молекула напоминает сложенную из кусков картину-головоломку, все части которой находятся на своих местах и где нет места еще каким-то кусочкам.
Так как это происходит от соединения и смешивания электронных волновых картин, химическая связь в своей основе имеет электрическую природу. Ее прочность обусловлена квантовой устойчивостью совокупной электронно-волновой картины образовавшейся молекулы. Рассмотрение различных конфигураций, показанных на фото V, позволяет легко понять, что существуют многочисленные способы соединения и переплетения электронных конфигураций. Вследствие этого мы ожидаем, что есть множество химических соединений разных типов.
Рассмотрим несколько специальных примеров. Среди многих способов, которыми соединяются атомы друг с другом, можно выделить связи двух важнейших типов. Один из них — связь типа «электронные близнецы», другой — типа «затычка и дыра» [39]. Характерный пример связи первого типа — связь в самой простой молекуле — молекуле водорода Н 2, состоящей всего из двух атомов водорода. Здесь две электронные картины, по одной от каждого атома, сливаются в одну новую картину, в результате чего сами атомы соединяются (см. рис. 28). Это слияние как будто противоречит принципу Паули, согласно которому каждую данную конфигурацию может принять только один электрон. На самом же деле противоречия нет; электрон обладает еще одним интересным свойством, о котором мы упомянем здесь только мимоходом: он вращается вокруг собственной оси. Это вращение называется электронным спином. Далее, здесь возможны только два вида вращения — вправо и влево вокруг данной оси. Поэтому каждую электронную картину надо считать дважды, потому что ее может принимать электрон, вращающийся как в одну, так и в другую сторону. Следовательно, два электрона могут принимать одну и ту же конфигурацию, только если они вращаются в противоположных направлениях. Вот почему электронный спин совместно с принципом Паули играет столь важную роль: две и только две электронные конфигурации могут слиться в одну общую. Молекула водорода может состоять только из двух атомов, но не из трех. Химическая связь становится насыщенной при наличии двух электронов на одной орбите.
Читать дальше
![Виктор Вайскопф Наука и удивительное [Как человек понимает природу] обложка книги](/books/32753/viktor-vajskopf-nauka-i-udivitelnoe-kak-chelovek-cover.webp)











