Выход бесцветных кристаллов, полученных в результате трудов Пера и Эсбьёрна, зависел от двух процессов, которые в то время оставались малопонятными. Один из них, вероятно, был первым из числа биотехнологических процессов, не применяющихся для увеличения срока хранения пищи. Так называемые нитрифицирующие бактерии почвы питались продуктами разложения содержащихся в навозе и моче белков, таких как мочевина (H 2NCONH 2), которая образуется при распаде азотсодержащей пептидной связи, соединяющей аминокислоты в белки.
Это похоже на то, что происходит на последних этапах изготовления сыра, и объясняет, почему зрелый бри или камамбер пахнут аммиаком (NH 3), а порой и самым настоящим скотным двором. Превращение NH 3в NO 3 —химически сложнее, поскольку требует полной смены окружения атома азота: из атома с тремя дополнительными электронами (химики называют это «степень окисления –3»), окруженного тремя атомами водорода, он должен стать нитрат-ионом (NO 3 —), которому недостает пяти электронов (степень окисления +5). Ниже приведена простая реакция, в которой мочевина – основной азотсодержащий компонент мочи, не имеющий запаха, – превращается в аммиак и углекислый газ:
H 2NCONH 2(т) + H 2O (ж) → CO 2(г) + 2NH 3(г),
где (ж), (г) и (т) обозначают жидкость, газ и твердое вещество соответственно.
Легко представить, как атомы азота хватают каждый по одному атому водорода из воды, а атом углерода цепляется за ставший одиноким атом кислорода из Н 2О. Одно короткое мгновение атомы держатся друг за друга, словно танцоры в хороводе, образуя замысловатое кольцо, а затем разлетаются в разные стороны, образуя новые созвездия. Мы называем подобную картину механизмом реакции.
А теперь в дело вступает биотехнология. Когда навоз и моча скапливаются в земле под ногами коров и лошадей, крошечные нитрифицирующие бактерии (которые не следует путать с азотфиксирующими бактериями [197] Нитрифицирующие бактерии получают энергию путем окисления неорганических соединений азота; азотфиксирующие бактерии усваивают молекулярный азот из воздуха и переводят его в органические соединения.
) принимаются за работу над молекулами аммиака. На самом деле эти бактерии живут за их счет, поскольку основным источником энергии для них является приведенная ниже реакция (в которой (aq) означает водный раствор):
6NH 3(г) + 12O 2(г) → 6HNO 3(aq) + 6H 2O (ж).
Эта реакция выглядит гораздо более сложной, чем предыдущая, а в реальности дело обстоит еще хуже, поскольку это лишь сильно упрощенная схема процесса, который состоит из множества различных индивидуальных реакций.
Путаницу вносит и то, что уравнение химической реакции может подразумевать две разные вещи. Когда мочевина встречается с водой, уравнение реакции описывает фактическое столкновение реагентов, в результате которого получается один или два продукта – в нашем случае это аммиак и углекислый газ. В подобные реакции обычно вступают только две молекулы, поскольку вероятность одновременного столкновения трех молекул крайне мала: точно так же встреча с другом в центре города субботним утром – это обычное дело, но, для того чтобы трое друзей сошлись в одном месте, обычно требуется некоторое предварительное планирование, не говоря уж о 18 молекулах, которые необходимы для приведенной выше реакции.
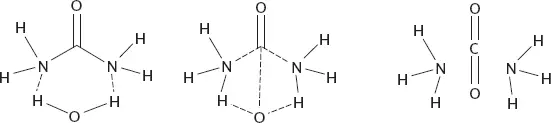
Рисунок 34.Упрощенный механизм реакции образования аммиака и углекислого газа из мочевины и воды. Пунктирные линии обозначают образующиеся новые связи или распадающиеся старые.
В реакции нитрификации, в свою очередь, мы рассматриваем систему целиком: что попадает внутрь бактерии или набора различных бактерий в почве и что выходит наружу. Подобным же образом дети заходят в систему школьного образования с одного конца и выходят инженерами-химиками с другого. Мы знаем, что в промежутке они проходят множество важных стадий, но в очень упрощенном виде работает это именно так. Так же как и в школьном образовании, где есть (наверное, к счастью) и другие выходы, кроме как стать инженером-химиком, это уравнение не описывает всех вариантов того, что происходит с атомами азота. Однако, если мы попытаемся создать для бактерий идеальные условия, как это делалось в XVIII веке, когда строили специальные селитряные амбары, мы сможем заставить большую часть атомов азота пойти по желаемому пути.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













