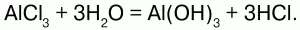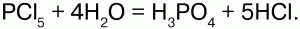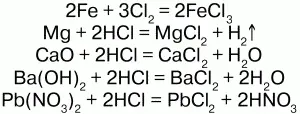Тяжелая водабыла открыта в 1932 г. Г. Юри, Ф. Брикведдеи Дж. Мерфи, впервые получена в чистом виде и изучена в 1933 г. Г. Льюисоми P. Макдональдом. При электролизе обыкновенной воды, включающей в себя молекулы НО, существует также малая доля молекул DO, образованных тяжелым изотопом водорода. Разлагаются в основном молекулы НО, поэтому при длительном электролизе воды остаток постепенно обогащается молекулами DO. В 1933 годуиз такого остатка электролиза удалось выделить небольшое количество воды с молекулярным составом DО, которая получила название тяжелая вода.
В смеси D2Oи H2Oс большой скоростью протекает изотопный обмен: H2O + D2O = 2HDO
Дейтерий обычно присутствует в воде в малом количестве ( HDO), реже в большом – D2O.
Строение молекулы тяжелой воды аналогично строению простой воды, отличия существуют лишь в длине связей и углов между ними. При конденсированном состоянии наличествует водородная связь.
Химические и физические свойства.
У тяжелой воды температура кипения – 101,44 °C, температура плавления – 3,823 °C.
Кристаллы D2Oимеют такую же структуру, как и кристаллы обычного льда, различие в размерах элементарной ячейки очень мало (0,1 %). Тяжелая вода менее летуча, чем обыкновенная вода. Растворимость и растворяющая способность тяжелой воды ниже, чем у обычной воды. Она имеет меньшую ионизацию.
Получение. Тяжелую воду получают выделением воды или при окислении водорода, имеющего естественный изотопный состав. Производство тяжелой воды делиться на две стадии.
1. Начальное концентрирование (от природной концентрации равной 5—10 % из расчета D2O):
а) изотопный обмен между водой и H2S в двух-, трехступенчатой каскадной системе противоточных колонн по двухтемпературной схеме;
б) многоступенчатый электролиз воды с каталитическим изотопным обменом между водой и водородом;
в) низкотемпературная ректификация жидкого водорода с последующим сжиганием дейтерия и кислорода.
2. Изотопный обмен между водородом и аммиаком в присутствии Kи конечное концентрирование (от 5—10 % до 99,8 % D2O). Происходит ректификация воды с использованием вакуума или электролиза.
Применение.Используют в качестве замедлителя нейтронов и теплоносителя в энергетических и исследовательских ядерных реакторах на тепловых нейтронах, как источник дейтерия для термоядерного синтеза и как источник его в ускорителях частиц, изотопный индикатор. Замедляет биологические процессы.
Соли соляной кислоты или хлориды– соединения хлора со всеми элементами, имеющими меньшее значение электроотрицательности.
Хлориды металлов– твердые вещества. В основном хорошо растворимы в воде, но AgCl, CuCl, HgCl2, TlCl и PbCl2– малорастворимы. Хлориды щелочных и щелочноземельных металлов имеют нейтральную реакцию. Увеличение числа атомов хлора в молекулах хлоридов приводит к уменьшению полярности химической связи и термической стойкости хлоридов, увеличению их летучести и склонности к гидролизу. Растворы хлоридов других металлов имеют кислую реакцию вследствие гидролиза:
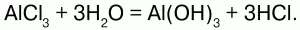
Хлориды неметаллов – вещества, которые могут быть в любом агрегатном состоянии: газообразные (HCl), жидкие (PCl3) и твердые (PCl5). Также вступают в реакцию гидролиза:
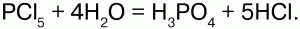
Некоторые хлориды неметаллов являются комплексными соединениями, например, РС15 состоит из ионов [РСl4]+ и [РСl6]-. Хлориды брома и йода относят к межгалогенным соединениям. Для ряда хлоридов характерна ассоциация и полимеризация в жидкой и газовой фазах с образованием хлоридных мостиков между атомами.
Получение.Получают реакцией металлов с хлором или взаимодействиями соляной кислоты с металлами, их оксидами и гидроксидами, также путем обмена с некоторыми солями:
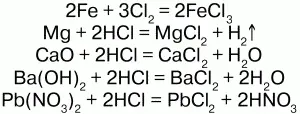
Определяют ион хлора качественно и количественно при помощи нитрата серебра. В результате этого образуется белый осадок в виде хлопьев.
Читать дальше
Конец ознакомительного отрывка
Купить книгу