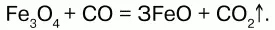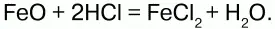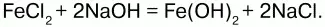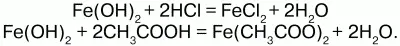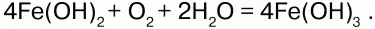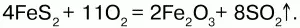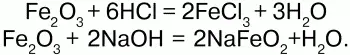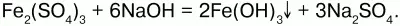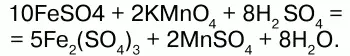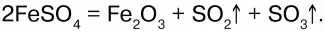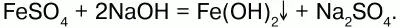1) переплавки в сталь в конвертерах, мартеновских или электрических дуговых печах;
2) литейный чугун используется в машиностроении для чугунного литья.
Оксид железа (II) FeO– черное кристаллическое вещество, нерастворимое в воде и щелочах. FeOсоответствует основание Fe(OH)2.
Получение.Оксид железа (II) можно получить неполным восстановлением магнитного железняка оксидом углерода (II):
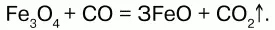
Химические свойства.Является основным оксидом. Реагируя с кислотами, образует соли:
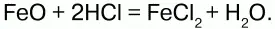
Гидроксид железа (II) Fe(OH)2– кристаллическое вещество белого цвета.
Получение.Гидроксид железа (II) получается из солей двухвалентного железапри действии растворов щелочей:
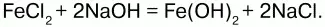
Химические свойства.Основный гидроксид. Вступает в реакции с кислотами:
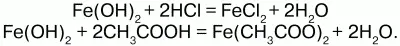
На воздухе Fe(OH)2 окисляется до Fе(ОН)3:
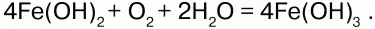
Оксид железа(III) Fe2O3– вещество бурого цвета, встречается в природе в виде красного железняка, нерастворим в воде.
Получение. При обжиге пирита:
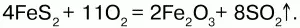
Химические свойства.Проявляет слабые амфотерные свойства. При взаимодействии со щелочами образует соли:
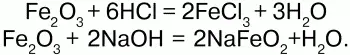
Гидроксид железа (III) Fe(OH)3– вещество красно-бурого цвета, нерастворимое в воде и избытке щелочи.
Получение. Получают путем окисления оксида железа (III) и гидроксида железа (II).
Химические свойства.Является амфотерным соединением (с преобладанием основных свойств). Выпадает в осадок при действии щелочей на соли трехвалентного железа:
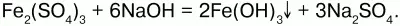
Соли двухвалентного железаполучают взаимодействием металлического железа с соответствующими кислотами. Они сильно гидро-лизуются, потому их водные растворы – энергичные восстановители:
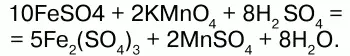
При нагревании выше 480 °C разлагается, образуя оксиды:
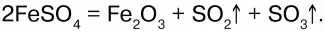
При действии щелочей на сульфат железа (II) образуется гидроксид железа (II):
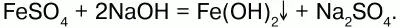
Образует кристаллогидрат – FeSO4?7Н2О (железный купорос). Хлорид железа (III) FeCl3 –кристаллическое вещество темно-коричневого цвета.
Химические свойства.Растворим в воде. FeCl3проявляет окислительные свойства.
Восстановители – магний, цинк, сероводород, окисляются без нагревания.
Доменный процесс –выплавка чугуна в доменной печи. Доменная печь выкладывается огнеупорными кирпичами высотой 30 м и внутренним диаметром 12 м. Верхняя половина – шихта оканчивается колошником, закрывающимся колошниковым затвором. Самую широкую часть печи называют распаром, а нижнюю – горном. Через фурмы (отверстия в горне) вдувают горячий воздух или кислород в печь. В доменную печь загружают слоями кокс и агломерат (сначала кокс).
Агломерат– руда, спеченная с флюсом. С помощью вдуваемого воздуха или кислорода поддерживается постоянная температура, необходимая для выплавки чугуна. В горне происходит сгорание угля и образование углекислого газа. Он поднимается наверх, проходит слои кокса и превращается в оксид углерода (II), который восстанавливает основную часть руды, окисляясь обратно в углекислый газ. В верхней части доменной печи и проходит процесс восстановления руды:
Читать дальше
Конец ознакомительного отрывка
Купить книгу