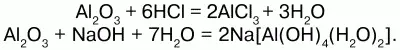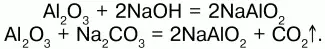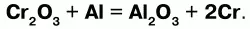Химические свойства:оксид алюминия проявляет амфотерные свойства – свойства кислотных оксидов и основных оксидов и реагирует и с кислотами, и с основаниями. Кристаллический Аl2О3 химически пассивен, аморфный – более активен. Взаимодействие с растворами кислот дает средние соли алюминия, а с растворами оснований – комплексные соли – гидроксоалюминаты металлов:
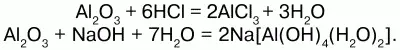
При сплавлении оксида алюминия с твердыми щелочами металлов образуются двойные соли – метаалюминаты(безводные алюминаты):
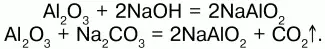
Оксид алюминия не взаимодействует с водой и не растворяется в ней.
Получение:оксид алюминия получают методом восстановления алюминием металлов из их оксидов: хрома, молибдена, вольфрама, ванадия и др. – металлотермия, открытый Бекетовым:
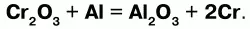
Применение:оксид алюминия применяется для производства алюминия, в виде порошка – для огнеупорных, химически стойких и аб-разивных материалов, в виде кристаллов – для изготовления лазеров и синтетических драгоценных камней (рубины, сапфиры и др.), окрашенных примесями оксидов других металлов – Сr2О3 (красный цвет), Тi2О3 и Fe2О3 (голубой цвет).
Гидроксид алюминия – А1(ОН)3. Физические свойства:гидроксид алюминия – белый аморфный (гелеобразный) или кристаллический. Почти не растворим в воде; молекулярная масса – 78,00, плотность – 3,97 г/см3.
Химические свойства:типичный амфотерный гидроксид реагирует:
1) с кислотами, образуя средние соли: Al(ОН)3 + 3НNO3 = Al(NO3)3 + 3Н2О;
2) с растворами щелочей, образуя комплексные соли – гидроксоалюминаты: Al(ОН)3 + КОН + 2Н2О = К[Al(ОН)4(Н2О)2].
При сплавлении Al(ОН)3 с сухими щелочами образуются метаалюминаты: Al(ОН)3 + КОН = КAlO2 + 2Н2О.
Получение:
1) из солей алюминия под действием раствора щелочей: AlСl3 + 3NaOH = Al(ОН)3 + 3Н2О;
2) разложением нитрида алюминия водой: AlN + 3Н2О = Аl(ОН)3 + NН3?;
3) пропусканием СО2 через раствор гидроксокомплекса: [Аl(ОН)4]-+ СО2 = Аl(ОН)3 + НСО3-;
4) действием на соли Аl гидратом аммиака; при комнатной температуре образуется Аl(ОН)3.
62. Общая характеристика подгруппы хрома
Элементы подгруппы хромазанимают промежуточное положение в ряду переходных металлов. Имеют высокие температуры плавления и кипения, свободные места на электронных орбиталях. Элементы хроми молибденобладают нетипичной электронной структурой – на внешней s-орбитали имеют один электрон (как у Nb из подгруппы VB). У этих элементов на внешних d– и s-орбиталях находится 6 электронов, поэтому все орбитали заполнены наполовину, т. е. на каждой находится по одному электрону. Имея подобную электронную конфигурацию, элемент обладает особенной стабильностью и устойчивостью к окислению. Вольфрамимеет более сильную металлическая связь, нежели молибден. Степень окисления у элементов подгруппы хрома сильно варьирует. В надлежащих условиях все элементы проявляют положительную степень окисления от 2 до 6, максимальная степень окисления соответствует номеру группы. Не все степени окисления у элементов стабильны, у хрома самая стабильная – +3.
Все элементы образуют оксид MVIO3, известны также оксиды с низшими степенями окисления. Все элементы данной подгруппы амфотерны – образуют комплексные соединения и кислоты.
Хром, молибдени вольфрамвостребованы в металлургии и электротехнике. Все рассматриваемые металлы покрываются пассивирующей оксидной пленкой при хранении на воздухе или в среде кислоты-окислителя. Удалив пленку химическим или механическим способом, можно повысить химическую активность металлов.
Хром.Элемент получают из хромитной руды Fe(CrO2)2, восстанавливая углем: Fe(CrO2)2 + 4C = (Fe + 2Cr) + 4CO?.
Чистый хром получают восстановлением Cr2O3 с помощью алюминия или электролиза раствора, содержащего ионы хрома. Выделяя хром с помощью электролиза, можно получить хромовое покрытие, используемое в качестве декоративных и защитных пленок.
Из хрома получают феррохром, применяемый при производстве стали.
Молибден.Получают из сульфидной руды. Его соединения используют при производстве стали. Сам металл получают при восстановлении его оксида. Прокаливая оксид молибдена с железом, можно получить ферромолибден. Используют для изготовления нитей и трубок для обмотки печей и электроконтактов. Сталь с добавлением молибдена используют в автомобильном производстве.
Читать дальше
Конец ознакомительного отрывка
Купить книгу