Радийоткрыт М. и П. Кюрисовместно с Ж. Белебномв 1898 г.Содержание в земной коре составляет 10–10%. Обладает естественной радиоактивностью. Соединения используются в исследованиях и для получения радона.
Кальций (Са) –химический элемент 2-й группы периодической системы, является щелочноземельным элементом. Природный кальций состоит из шести стабильных изотопов. Конфигурация внешней электронной оболочки 4s2; имеет степень окисления +2, реже +1. Содержание в земной коре составляет 3,38 %. Встречается исключительно в виде соединений, в основном солей кислородсодержащих кислот. Большое количество кальция находится в природных водах. Значительное количество кальция содержится в организмах многих животных.
Общие свойства.Кальций – серебристо-белый металл. Существует в двух аллотропных модификациях. На воздухе, имеющем пары воды, кальций быстро образует оксид СаОи гидроксид Са (ОН)2. Вступает в реакцию с кислородом, образуя СаО; при повышении температуры в кислороде и на воздухе воспламеняется. Из воды вытесняет водород Н2, при этом образуется Са(ОН)2, в холодной воде скорость реакции уменьшается. Взаимодействует с галогенами, образуя СаХ2. СН 2при нагревании кальция дает гидрид СаН2, в котором водород является анионом. Кальций, нагреваемый в атмосфере азота, загорается и образует нитрид Ca3N2. С углеродом образует кальция карбид СаС2, с бором – борид СаВ6. Образует соединения с металлами (Ag, Au, Al, Cu, Mg, Rb), вытесняет их из расплавов солей. Кальций растворим в жидком аммиаке NH3с образованием синего раствора. Соли получают при взаимодействии кислотных оксидов с оксидом кальция. Они хорошо растворимы, способны образовывать кристаллогидраты.
В водных растворах образуются комплексы преимущественно с кислотосодержащими лигандами, имеющие в своем составе ион Са2+. На основе этих комплексов основано действие умягчителей воды – полифосфатов натрия. Ион Са2+в неводных растворах образует комплексы с молекулами растворителя.
Получение.Промышленное получение кальция состоит в алюмотермическом восстановлении оксида кальция и электролизе расплава хлорида кальция (75–85 %) и хлорида калия. Безводный хлорид кальция получают путем хлорирования его оксида в присутствии угля или обезвоживая кристаллогидрат хлорида кальция. По мере выделения кальция в расплаве в него добавляют хлорид кальция. Электролиз проводят, используя графитовый анод и в качестве катода – жидкий расплав кальция (62–65 %) и меди.
Применение. Кальций используют при ме-таллотермическом получении U, Th, Ti, Z r, Cs, Rb и некоторых лантаноидов, для удаления примесей кислорода, азота, серы, фосфора из сплавов, обезвоживания органических жидкостей, очистки Аr от примеси N2. Используются и соединения кальция, например, в качестве вяжущих материалов.
57. Оксид и гидроксид кальция
Оксид кальция (СаO) – негашеная или жженая известь– белое огнестойкое вещество, образованное кристаллами. Кристаллизуется в кубической гранецентрированной кристаллической решетке. Температура плавления – 2627 °C, температура кипения – 2850 °C.
Называется жженой известью из-за способа его получения – обжигание карбоната кальция. Обжиг производят в высоких шахтных печах. В печь закладывают слоями известняк и топливо, а затем разжигают снизу. При накаливании происходит разложение карбоната кальция с образованием оксида кальция:
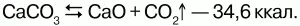
Так как концентрации веществ в твердых фазах неизменны, то константу равновесия этого уравнения можно выразить так: K = [CO2].
При этом концентрация газа может быть выражена с помощью его парциального давления, то есть равновесие в системе устанавливается при определенном давлении диоксида углерода.
Давление диссоциации вещества– равновесное парциальное давление газа, получающееся при диссоциации вещества.
Чтобы спровоцировать образование новой порции кальция, необходимо повысить температуру или удалить часть получившегося CO2, при этом уменьшится парциальное давление. Поддерживая постоянное более низкое парциальное давление, чем давление диссоциации, можно добиться непрерывного процесса получения кальция. Для этого при обжигании извести в печах делают хорошую вентиляцию.
Читать дальше
Конец ознакомительного отрывка
Купить книгу