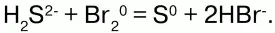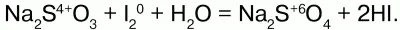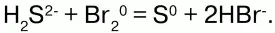
Бром с нулевой степенью окисления окисляет серу (-2) до 0, сам при этом восстанавливаясь до -1.
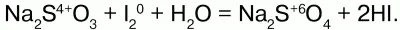
Йод (0) окисляет серу (+4) до +6, восстанавливаясь до -1.
Галогены нашли широкое применение в химической промышленности: фтор используют в синтезе полимеров – фторопластов, пластмассы, стойкой к химическим воздействиям (тефлон), смазочных веществ, жидкостей для холодильников (фреоны). Бром используется в изготовлении лекарственных препаратов, некоторых красителей; йод широко используется в медицине – 10 %-ный раствор йода в спирте – как антисептическое, дезинфицирующее средство, йод входит в состав некоторых фармацевтических препаратов. Также бром и йод используются при различных синтезах и анализах веществ.
22. Общая характеристика подгруппы кислорода
Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделле-ва, включающая следующие элементы:
1) кислород – О;
2) сера – S;
3) селен – Se;
4) теллур – Te;
5) полоний – Po (радиоактивный элемент).
Номер группы указывает на максимальную валентность элементов, стоящих в этой группе. Общая электронная формула халькогенов: ns2np4– на внешнем валентном уровне у всех элементов имеется 6 электронов, которые редко отдают и чаще принимают 2 недостающих до завершения уровня электрона. Наличие одинакового валентного уровня обуславливает химическое сходство халькогенов. Характерные степени окисления: -1; -2; 0; +1; +2; +4; +6. Кислород проявляет только -1 – в пероксидах; -2 – в оксидах; 0 – в свободном состоянии; +1 и +2 – во фторидах – О2F2, ОF2 т. к. у него нет d-под-уровня и электроны разъединяться не могут, и валентность всегда – 2; S – все, кроме +1 и -1. У серы появляется d-подуровень и электроны с 3р и с 3s в возбужденном состоянии могут разъединиться и уйти на d-подуровень. В невозбужденном состоянии валентность серы – 2 – в SО, 4 – в SО2, 6 – в SО3. Se +2; +4; +6, Te +4; +6, Po +2; -2. Валентности у селена, теллура и полония также 2, 4, 6. Значения степеней окисления отражены в электронном строении элементов: О – 2s22p4; S – 3s23p4; Se – 4s24p4; Te – 5s25p4; Po – 6s26p4. Сверху вниз, с нарастанием внешнего энергетического уровня закономерно изменяются физические и химические свойства халькогенов: радиус атома элементов увеличивается, энергия ионизации и сродства к электрону, а также электроотрицательность уменьшаются; уменьшаются неметаллические свойства, металлические увеличиваются (кислород, сера, селен, теллур – неметаллы), у полония имеется металлический блеск и электропроводимость. Водородные соединения халькогенов соответствуют формуле: H2R: H2О, H2S, H2Sе, H2Те – хальководороды.Водород в этих соединениях может быть замещен на ионы металлов. Степень окисления всех халькогенов в соединении с водородом -2 и валентность тоже 2. При растворении хальководородов в воде образуются соответствующие кислоты. Эти кислоты – восстановители. Сила этих кислот сверху вниз возрастает, т. к. уменьшается энергия связи и способствует активной диссоциации. Кислородные соединения халькогенов отвечают формуле: RО2 и RО3 – кислотные оксиды. При растворении этих оксидов в воде они образуют соответствующие кислоты: Н2RО3 и Н2RO4. В направлении сверху вниз сила этих кислот убывает. Н2RО3 – кислоты-восстановители, Н2RO4 – окислители.
23. Кислород и его свойства
Кислород (О)стоит в 1 периоде, VI группе, в главной подгруппе. р-элемент. Электронная конфигурация 1s2 2s22p4 . Число электронов на внешнем уровне – 6. Кислород может принять 2 электрона и в редких случаях отдать. Валентность кислорода 2, степень окисления -2.
Физические свойства:кислород (О2 )– бесцветный газ, без запаха и вкуса; в воде малорастворим, немного тяжелее воздуха. При -183 °C и 101,325 Па кислород сжижается, приобретая голубоватый цвет. Строение молекулы:молекула кислорода двухатомна, в обычных условиях прочная, обладает магнитными свойствами. Связь в молекуле ковалентная неполярная. Кислород имеет аллотропную модификацию – озон(О3 ) –более сильный окислитель, чем кислород.
Химические свойства:до завершения энергетического уровня кислороду нужно 2 электрона, которые он принимает проявляя степень окисления -2, но в соединении со фтором кислород ОF2 -2 и О2F2 -1. Благодаря химической активности кислород взаимодействует почти со всеми простыми веществами. С металлами образует оксиды и пероксиды:
Читать дальше
Конец ознакомительного отрывка
Купить книгу