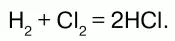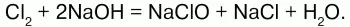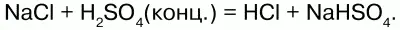20. Хлор. Хлороводород и соляная кислота
Хлор (Cl) –стоит в 3-м периоде, в VII группе главной подгруппы периодической системы, порядковый номер 17, атомная масса 35,453; относится к галогенам.
Физические свойства:газ желто-зеленого цвета с резким запахом. Плотность 3,214 г/л; температура плавления -101 °C; температура кипения -33,97 °C, При обычной температуре легко сжижается под давлением 0,6 МПа. Растворяясь в воде, образует хлорную воду желтоватого цвета. Хорошо растворим в органических растворителях, особенно в гексане (C6H14), в четырех-хлористом углероде.
Химические свойства хлора:электронная конфигурация: 1s22s22p63s22p5. На внешнем уровне 7 электронов. До завершения уровня нужен 1 электрон, который хлор принимает, проявляя степень окисления -1. Существуют и положительные степени окисления хлора вплоть до + 7. Известны следующие оксиды хлора: Cl2O, ClO2, Cl2O6 и Cl2O7. Все они неустойчивы. Хлор – сильный окислитель. Он непосредственно реагирует с металлами и неметаллами:

Реагирует с водородом. При обычных условиях реакция идет медленно, при сильном нагревании или освещении – со взрывом, по цепному механизму:
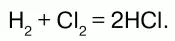
Хлор взаимодействует с растворами щелочей, образуя соли – гипохлориты и хлориды:
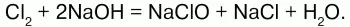
При пропускании хлора в раствор щелочи образуется смесь растворов хлорида и гипохлорита:

Хлор – восстановитель: Cl2 + 3F2 = 2ClF3.
Взаимодействие с водой:

Хлор не взаимодействует непосредственно с углеродом, азотом и кислородом.
Получение:2NaCl + F2 = 2NaF + Cl2.
Электролиз:2NaCl + 2H2O = Cl2 + H2 + 2NaOH.
Нахождение в природе:содержится в составе минералов: галит (каменная соль), сильвин, бишофит; морская вода содержит хлориды натрия, калия, магния и других элементов.
Хлороводород HCl. Физические свойства:бесцветный газ, тяжелее воздуха, хорошо растворим в воде с образованием соляной кислоты.
Получение:в лаборатории:
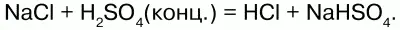
В промышленности: сжигают водород в струе хлора. Далее хлороводород растворяют в воде, и получают соляную кислоту (см. выше).
Химические свойства: соляная кислота – сильная, одноосновная, взаимодействует с металлами, стоящими в ряду напряжений до водорода: Zn + 2HCl = ZnCl2 + H2.
Как восстановитель реагирует с оксидами и гидроксидами многих металлов:

21. Краткие сведения о фторе, броме и йоде
Фтор (F); бром (Br); йод (I)относятся к группе галогенов. Стоят в 7-й группе главной подгруппы периодической системы. Общая электронная формула: ns2np6.
Физические свойства: F2 – бесцветный, трудно сжижающийся газ; Br2 – жидкость красно-бурого цвета, легко испаряется, образуя красно-бурые пары; I2 – кристаллическое вещество фиолетового цвета со слабым металлическим блеском, при постепенном нагревании йод сублимируется, превращаясь в пар, минуя жидкое состояние. Бром и йод малорастворимы в воде, хорошо растворяются в органических растворителях – в бензине, бензоле, спирте. Химические свойства:галогены – ярко выраженные неметаллы. Фтор F2 – связь ковалентная неполярная обладает высокой химической активностью, за счет маленького радиуса атома, является сильнейшим окислителем. Фтор реагирует практически со всеми простыми и сложными веществами. Окисляет кислород, образуя фториды кислорода: ОF2 и О2F2. Вступает во взаимодействие даже с некоторыми инертными газами: 2F2 + Хе = ХеF4.
Не реагирует фтор только с гелием, неоном и аргоном . Водородное соединение фтора – НF (фтороводород) при растворении в воде образует плавиковую кислоту. Бром и йод тоже вступают в реакции со многими соединениями, особенно с металлами, которые сгорают в них и образуются соответствующие соли. Металлы при этом отдают электроны, а галогены их принимают, являясь окислителями. При растворении в воде дает бромную воду. Молекулы их также двухатомные, ковалентные неполярные, но они менее активны, чем фтор, что объясняется большим радиусом атома у брома и йода, чем у фтора. Все галогены – активные окислители, что проявляется при взаимодействии их с различными сложными веществами – смешивание сероводородной воды с раствором брома:
Читать дальше
Конец ознакомительного отрывка
Купить книгу