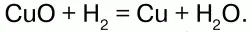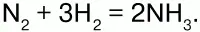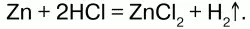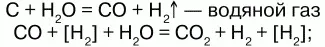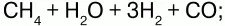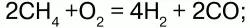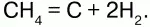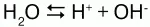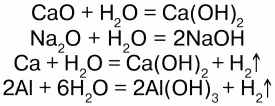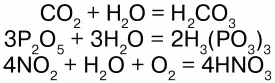1 ...7 8 9 11 12 13 ...43 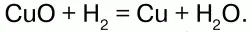
С многими неметаллами H образует газообразные соединения: СН4, SiH4 – силан, Н2S – сероводород и др. Синтезом Н с N получают аммиак:
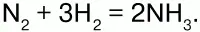
Особо активен атомарный H. Он реагирует с кислородом без поджигания: 2Н? + О2 = Н2О2. Без нагревания восстанавливает многие неметаллы. С галогенами реагирует быстро, даже в темноте.
Получение:в лаборатории в аппарате Кипа воздействием на него НСl или Н2SО4 с Zn:
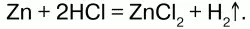
Или электролизом воды с добавлением NаОН.
В промышленности Н получают:
а) конверсией воды:
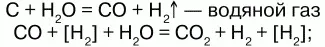
б) конверсией СН4:
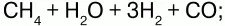
в) кислородной конверсией:
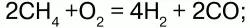
г) нагреванием СН4:
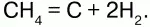
Из оксидов водорода самым распространенным на Земле является вода.Эмпирическая формула – Н2О.Молекулярная масса – 18. Строение молекулы воды(структурная формула):
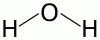
Молекулы воды имеют треугольную формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электронная плотность сосредотачивается на атоме кислорода, а вблизи атомов водорода образуется положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородные связи. Последние обуславливают все физические свойства воды.
Физические свойства:вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства:вода незначительно диссоциирует:
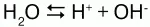
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:

Взаимодействует со многими основными оксидами, металлами:
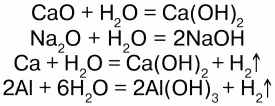
С кислотными оксидами:
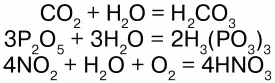
Получение:вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О
Эта реакция протекает мгновенно при 700 °C. Смесь двух объемов водорода и одного объема кислорода называется гремучей смесью. Методом перегонки получают чистую воду – дистиллированную воду.
Нахождение в природе:вода составляет 2/3 поверхности Земли. Природная вода не бывает чистой, т. к. в ней растворено огромное количество солей. Вода входит в состав многих кристаллогидратов: Nа2СО3 ? 10Н2О; CuSO4 ? 5Н2О; MgSO4? 7Н2О. Тяжелая вода D2Оотличается от обычной, образованной водородом – протием – наличием в ней второго изотопа водорода – D(дейтерия), Аr которого – 2, следовательно, молекулярная масса тяжелой воды – 20. Плотность D2О =1,1050 г/см3; температура кипения – 101,4 °C, замерзания – 3,8 °C. Химически менее активна. Применяется в качестве замедлителя нейтронов в ядерных реакторах. Она непригодна для жизненных процессов, т. к. изменяет скорость биохимических реакций. В обычной воде частично содержится тяжелая вода.
Пероксид, или перекись водорода– кислородное соединение водорода (перекись). Формула: Н2О2 Физические свойства:перекись водорода – бесцветная сиропообразная жидкость, плотность – 1,45 г/см3относится к числу очень слабых, т. к. в очень малой степени диссоциирует: по I ступени:
Читать дальше
Конец ознакомительного отрывка
Купить книгу