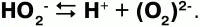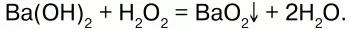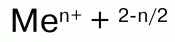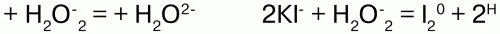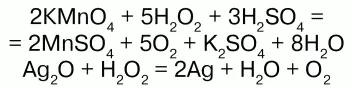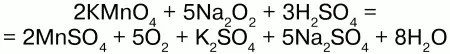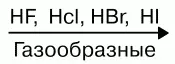1 ...8 9 10 12 13 14 ...43 
по II ступени:
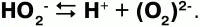
Химические свойства:при взаимодействии концентрированного раствора Н2О2 сгидроксидами металлов образуются их пероксиды: Na2O2, CaO, MgO2 идр.
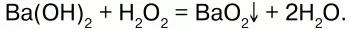
Пероксиды, или перекиси– это соли Н2О2, состоящие из положительно заряженных ионов металлов и отрицательно заряженных ионов О22-, электронное строение их аниона следующее:
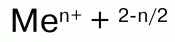
Н2О2 проявляет окислительно-восстановительные свойства: окисляет вещества стандартный электронный потенциал которых (Е°) не превышает 1,776 В; восстанавливает вещества у которых Е° больше 0,682 В. Окислительно-восстановительные свойства Н2О2объясняются тем, что степень окисления -1 у атомов кислорода имеет промежуточное значение между степенями окисления -2 и 0. Более характерны для него окислительные свойства.
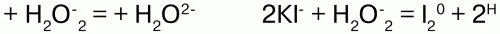
Н2О2 здесь выступает окислителем.
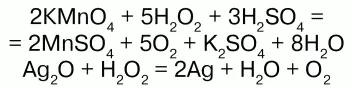
В этих случаях пероксид водорода является восстановителем.
Соли H2O2 –пероксиды (перекиси) также обладают окислительно-восстановительными свойствами:
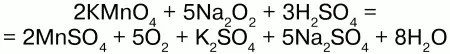
Здесь Na2O2 – восстановитель.
Получение:в промышленности H2O2 получают взаимодействием разбавленной серной кислотой с пероксидом бария ВаО2: H2SO4(разб.) + ВаО2= ВаSO4 + H2O2, а также путем перегонки пергидроля в вакууме получается концентрированный пероксид водорода. Пергидроль– 30 %-ный водный раствор H2O2. Окислительная способность и безвредность применения пероксида водорода дала возможность широкого использования его во многих отраслях народного хозяйства: в промышленности – для отбеливания тканей, мехов; в пищевой промышленности – для консервирования продуктов; в сельском хозяйстве – для протравливания семян, в производстве ряда органических соединений, например, в производстве глицерина: промежуточный продукт при получении глицерина – аллиловый спирт СН2 = СН – СН2ОН окисляют при помощи H2O в глицерин С3Н5(ОН)3, используется в ракетной технике как сильный окислитель. 3 %-ный H2O2 применяется в фармацевтике в медицинских целях как дезинфицирующее средство.
19. Общая характеристика подгруппы галогенов
Галогены– элементы VII группы – фтор, хлор, бром, йод, астат (астат мало изучен в связи с его радиоактивностью). Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами.
В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5. Это значит, что галогены имеют 7 валентных электронов, кроме фтора.

Физические свойства галогенов:F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.
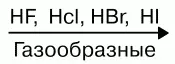
Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:
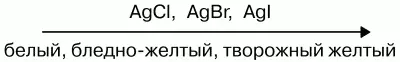
Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде. Все галогены в свободном состоянии – окислители . Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал. Фтор – самый сильный окислитель . Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе.
Читать дальше
Конец ознакомительного отрывка
Купить книгу