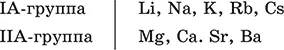Элементыусловно делятся на элементы с металлическими и неметаллическими свойствами. Первые из них всегда входят в состав катионовмногоэлементных веществ (металлические свойства), вторые – в состав анионов (неметаллические свойства). В соответствии с Периодическим законом в периодах и группах между этими элементами находятся амфотерные элементы, проявляющие одновременно в той или иной мере металлические и неметаллические (амфотерные, двойственные) свойства. Элементы VIIIA-группы продолжают рассматривать отдельно (благородные газы), хотя для Kr, Хе и Rn обнаружены явно неметаллические свойства (элементы Не, Ne, Ar химически инертны).
Классификация простых и сложных неорганических веществ приведена в табл. 6.
Ниже приводятся определения (дефиниции) классов неорганических веществ, их важнейшие химические свойства и способы получения.
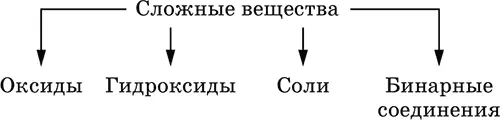
Неорганические вещества– соединения, образуемые всеми химическими элементами (кроме большинства органических соединений углерода). Делятся по химическому составу:

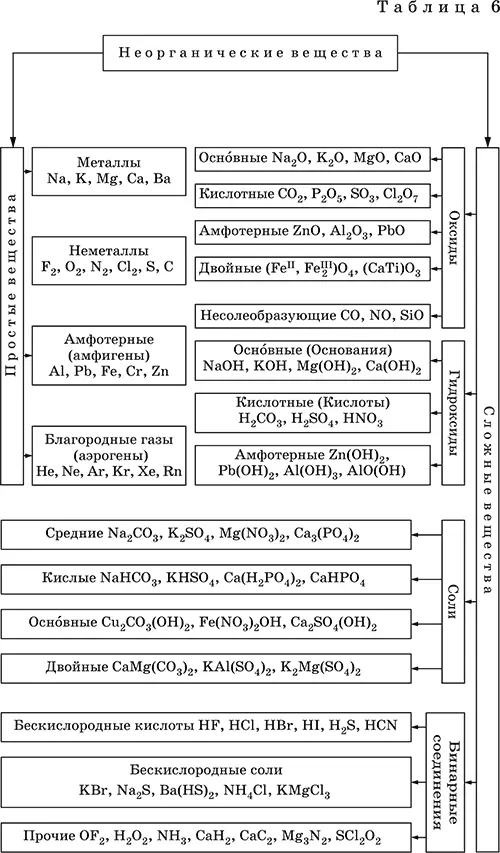
Простые веществаобразованы атомами одного элемента. Делятся по химическим свойствам:

Металлы– простые вещества элементов с металлическими свойствами (низкая электроотрицательность). Типичные металлы:
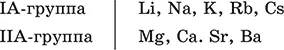
Металлы обладают высокой восстановительной способностью по сравнению с типичными неметаллами. В электрохимическом ряду напряжений они стоят значительно левее водорода, вытесняют водород из воды (магний – при кипячении):

Простые вещества элементов Cu, Ag и Ni также относят к металлам, так как у их оксидов CuO, Ag 2O, NiO и гидроксидов Cu(OH) 2, Ni(OH) 2преобладают основные свойства.
Неметаллы– простые вещества элементов с неметаллическими свойствами (высокая электроотрицательность). Типичные неметаллы: F 2, Cl 2, Br 2, I 2, O 2, S, N 2, Р, С, Si.
Неметаллы обладают высокой окислительной способностью по сравнению с типичными металлами.
Амфигены– амфотерные простые вещества, образованные элементами с амфотерными (двойственными) свойствами (электроотрицательность промежуточная между металлами и неметаллами). Типичные амфигены: Be, Cr, Zn, Аl, Sn, Pb.
Амфигены обладают более низкой восстановительной способностью по сравнению с типичными металлами. В электрохимическом ряду напряжений они примыкают слева к водороду или стоят за ним справа.
Аэрогены– благородные газы, одноатомные простые вещества элементов VIIIA-группы: Не, Ne, Ar, Kr, Xe, Rn. Из них He, Ne и Ar химически пассивны (соединения с другими элементами не получены), а Kr, Хе и Rn проявляют некоторые свойства неметаллов с высокой электроотрицательностью.
Сложные веществаобразованы атомами разных элементов. Делятся по составу и химическим свойствам:
Оксиды– соединения элементов с кислородом, степень окисления кислорода в оксидах всегда равна (-II). Делятся по составу и химическим свойствам:
Элементы He, Ne и Ar соединений с кислородом не образуют. Соединения элементов с кислородом в других степенях окисления – это не оксиды, а бинарные соединения, например O +IIF 2 -Iи H 2 +IO 2 -I. Не относятся к оксидам и смешанные бинарные соединения, например S +IVCl 2 -IO -II.
Оснóвные оксиды– продукты полной дегидратации (реальной или условной) основных гидроксидов, сохраняют химические свойства последних.
Из типичных металлов только Li, Mg, Ca и Sr образуют оксиды Li 2O, MgO, СаО и SrO при сжигании на воздухе; оксиды Na 2O, К 2O, Rb 2O, Cs 2O и ВаО получают другими способами.
Оксиды CuO, Ag 2O и NiO также относят к основным.
Кислотные оксиды– продукты полной дегидратации (реальной или условной) кислотных гидроксидов, сохраняют химические свойства последних.
Читать дальше
Конец ознакомительного отрывка
Купить книгу